
下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾 Na(l)+KCl(l)
 NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
科目:高中化学 来源: 题型:
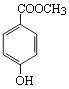 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。
① 下列对尼泊金酯的判断不正确的是______。
a.能发生水解反应 b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上 d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是
,
其中包含的反应类型有 、 。
(2)C8H8O3的另一种同分异构体甲满足以下条件:
① 与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH
② 遇FeCl3溶液显色③ 苯环上的一氯取代物只有一种
甲可能的结构简式是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
只用一种试剂可区别Na2SO4 、MgCl2 、FeCl2 、Al2(SO4)3 、(NH4)2SO4五种溶液,
这种试剂是
A.NaOH B.H2SO4 C.Ba(OH)2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
除去工业尾气中的氮氧化物,常用氨催化吸收法。原理是NH3与NOx反
应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置
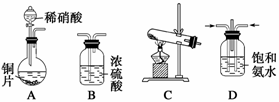
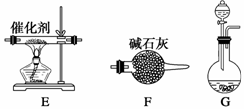
(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的有 (填序号)。
① 用赤热的炭与水蒸气反应制取氢气 ② 用排饱和食盐水的方法收集氯气
③ 实验室制氧气有时需要加热,有时不需要加热 ④ 用无水氯化钙干燥氨气
(2)若选择装置G制取氨气,则分液漏斗中盛装的液体试剂是 。
(3)若选择装置C制取氨气,则反应的化学方程式是 。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
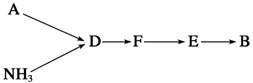
(4)A装置中反应的离子方程式为__________________________________。
(5)D装置中的液体可换成 (填序号)。
a . CuSO4 b . H2O c . CCl4 d . 浓硫酸
(6)该同学所设计的模拟尾气处理实验存在的明显缺陷是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1”可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1
D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;该反应的熵ΔS________0(选填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐增强
D.LiOH、NaOH、KOH的碱性依次逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为x2-和z-,Y+ 和z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B、单质活泼性: X>Y>Z
C. 原子序数: X>Y>Z D、离子半径: X2—>Y+>Z—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com