
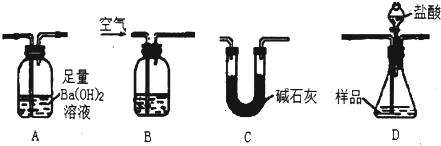
要求设计实验证明,某种盐的水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D. 在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
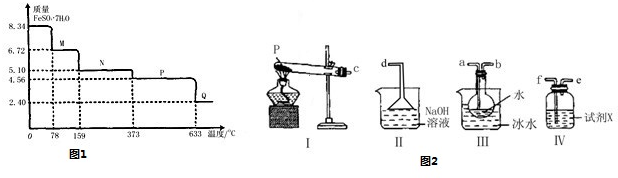
(1)设计的理论依据是______________________________;
(2)实验的简要步骤是______________________________;
(3)需记录的现象和数据是__________________________;
(4)推断与分析:由于________________________,说明________________________,所以醋酸是弱酸。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市宽甸二中高一上学期期末考试化学试卷(带解析) 题型:实验题
(16分)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。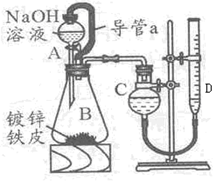
回答下列问题 :
(1)仪器名称A _B
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D (具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后 ,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为 。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液 。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:
|

查看答案和解析>>
科目:高中化学 来源:2015届辽宁省丹东市高一上学期期末考试化学试卷(解析版) 题型:实验题
(16分)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。
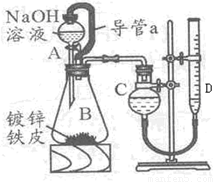
回答下列问题 :
(1)仪器名称A _B
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D (具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后 ,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为 。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液 。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com