
| A. | 用托盘天平称量8.70g食盐 | |
| B. | 用广泛pH试纸测定氯水的pH值为3.5 | |
| C. | 在蒸发皿中灼烧氢氧化铁获得铁红 | |
| D. | 用加热的方法分离氯化钠和氯化铵的固体混合物 |
分析 A、托盘天平只能精确到0.1g;
B、广泛pH实质只能精确到1;
C、物质的灼烧应在坩埚中进行;
D、氯化铵受热易分解,而NaCl受热不分解.
解答 解:A、托盘天平只能精确到0.1g,故不能用托盘天平称量出8.70g食盐,故A错误;
B、广泛pH实质只能精确到1,故不能测得溶液的pH为3.5,故B错误;
C、物质的灼烧应在坩埚中进行,不能在蒸发皿中进行,故C错误;
D、氯化铵受热易分解,而NaCl受热不分解,则用加热的方法分离氯化钠和氯化铵的固体混和物,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及混合物的分离、质量的称量、量取溶液等,注重基础知识的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
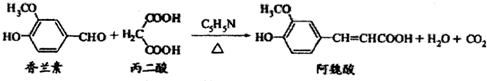
| A. | 1mol阿魏酸与足量溴水反应,消耗1molBr2 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、水解反应 | |
| D. | 香兰素与足量氢气完全反应后的产物,其1个分子中含有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
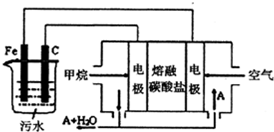 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 浓硫酸不可干燥氨气、二氧化硫等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
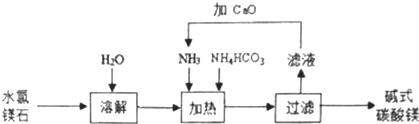
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
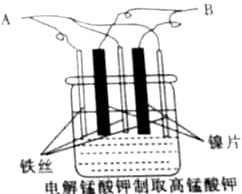 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com