
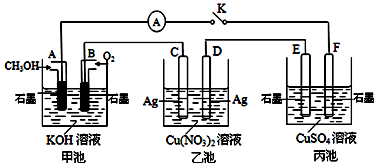
分析 甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;乙池是电解池,C为阳极,D为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;丙为电解池E为阳极,F为阴极,电解硫酸铜溶液产物是金属铜、氧气和硫酸.
解答 解:甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O,乙池是电解池,C为阳极,D为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
(1)当乙池中C极质量减轻10.8g时,即消耗金属银是10.8g,即0.1mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=$\frac{0.1}{4}$mol×22.4L/mol=0.56L=560ml;故答案为:560;
(2)丙为电解池E为阳极,F为阴极,电解硫酸铜溶液产物是金属铜、氧气和硫酸,即2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,得到关系2e-~H2SO4,
乙池中C极质量减轻10.8g时,即消耗金属银是10.8g,转移电子是0.1mol,所以得到硫酸物质的量是0.05mol,所以氢离子浓度$\frac{0.05mol×2}{1L}$=0.1mol/L,即pH=1,故答案为:1.
点评 本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol H2和4.48L HCl气体 | B. | 标准状况下1mol O2和22.4L H2O | ||
| C. | 2g 氦气和标准状况下11.2L CO2 | D. | 4L CO和4L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com