
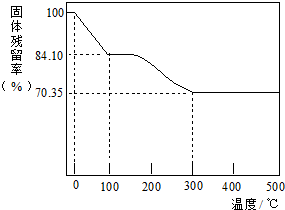
分析 (1)碳酸氢钠受热易分解,保持100℃,使结晶水失去,而不引起NaHCO3分解;
(2)假设固体为100g,根据固体残留率求出水的质量、碳酸氢钠的质量和碳酸钠的质量,再分别求出物质的量,根据物质的量之比计算a、b、c;
(3)根据aNa2CO3•bNaHCO3•cH2O与HCl反应中物质的量的关系计算.
解答 解:(1)已知在100℃时,晶体失去结晶水,而不引起NaHCO3分解,所以加热过程中,保持100℃足够长时间,确保晶体中的结晶水失去完全,同时防止稍稍升温引起NaHCO3分解;
故答案为:确保晶体中的结晶水失去完全,同时防止稍稍升温引起NaHCO3分解;
(2)假设固体为100g,则水的物质的量为$\frac{100-84.10}{18}$mol,
100℃---300℃固体减少的质量为碳酸氢钠分解生成的二氧化碳和水的质量,2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2+H2O,则NaHCO3的物质的量为($\frac{84.10-70.35}{62}$×2)mol,
最后剩余的固体为原来的碳酸钠和碳酸氢钠分解生成的碳酸钠,则原来是碳酸钠的物质的量为($\frac{70.35}{106}$-$\frac{84.10-70.35}{62}$)mol,
则a:b:c=($\frac{70.35}{106}$-$\frac{84.10-70.35}{62}$):($\frac{84.10-70.35}{62}$×2):$\frac{100-84.10}{18}$=1:1:2;
故答案为:1:1:2;
(3)由以上分析可知,该物质的化学式为Na2CO3•NaHCO3•2H2O,则其物质的量为$\frac{0.113g}{226g/mol}$=0.0005mol,n(CO2)=$\frac{0.0056L}{22.4L/mol}$=0.00025mol,
Na2CO3 +HCl=NaHCO3 +NaCl
0.0005mol 0.0005mol
NaHCO3 +HCl=NaCl+CO2↑+H2O
0.00025mol 0.00025mol
则c(HCl)=$\frac{n}{V}$=$\frac{0.0005mol+0.00025mol}{0.005L}$=0.1500 mol/L,
故答案为:0.1500.
点评 本题考查了碳酸钠和碳酸氢钠、有关化学方程式的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意根据图象分析固体的成分.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | HCl溶液 | C. | NaOH溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | p点横坐标为120 | |
| C. | p点中溶质为Ba(HCO3)2 | |
| D. | ab段反应可分两段,离子方程式依次为:CO2+2OH-=H2O+CO32- CO2+H2O+CO32-=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(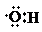 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
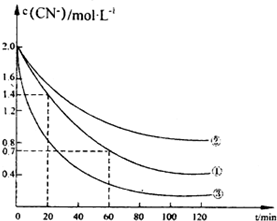 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com