
| A. | 因为H-F的键能大于H-CI,所以HF的沸点高于HCI | |
| B. | 因为HCIO4比HCIO中的氯元素的化合价高,所以HCIO4的氧化性强于HCIO | |
| C. | 因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3 | |
| D. | 因为Fe的还原性强于Cu,所以Cu2+的氧化性强于Fe3+ |
分析 A.HF分子间能形成氢键,根据氢键对物理性质的影响分析;
B.HCIO4和HCIO氧化性与氯元素价态的稳定性有关与化合价高低无关;
C.非金属性越强,氢化物越稳定;
D.三价铁离子氧化性大于铜离子.
解答 解:A.HF分子间能形成氢键,HCl分子间不能形成氢键,氢化物中含有氢键的熔沸点较高,HF的沸点高于HCl,与分子内的共价键无关,故A错误;
B.次氯酸中+1价的氯不稳定所以二者氧化性强弱关系为:HClO>HClO4,故B错误;
C.非金属性越强,氢化物越稳定,因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3,故C正确;
D.三价铁离子氧化性大于铜离子,铜离子氧化性大于二价铁离子,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉氢键对物质性质的影响、熟悉氧化性强弱的规律、非金属强弱的判断依据是解题关键,题目难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
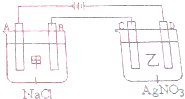
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验目的 | |
| A | 乙醇、乙酸与浓硫酸混合共热一段时间,对混合液直接蒸馏 | 制备纯净的乙酸乙酯 |
| B | 将某气体通入品红溶液,溶液褪色 | 检验气体中的SO2 |
| C | 测定等物质的量浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| D | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一种有机化合物的结构简式为:
一种有机化合物的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
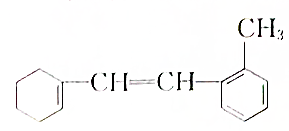 :
:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| C. | 铁质器件附有铜质配件,接触处容易生铁锈 | |
| D. | 银质奖牌放置久了表面变暗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com