
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
|
实验序号 |
1 |
2 |
3 |
4 |
5 |
|
硝酸溶液体积 |
100 mL |
200 mL |
300 mL |
400 mL |
500 mL |
|
剩余固体的质量 |
17.2 g |
8 .0g |
0 g |
0 g |
0 g |
|
气体体积 |
2.24 L |
4.48 L |
6.72 L |
7.84 L |
7.84 L |
求:(1)该实验中所用稀硝酸的物质的量浓度;
(2)每一等份的混合物粉末中铜的质量。
(1)该实验中所用稀硝酸的物质的量浓度为4 .0mol/L;
(2)实验中每次所取混合物粉末中铜的质量为14.4g。(其它合理解法,同样给分)
【解析】
试题分析:根据表中数据分析:实验1后剩余的17.2g固体只可能为Cu或Fe、Cu;实验5中金属完全反应,生成n(NO)=7.84L÷22.4L/mol=0.35mol,反应后溶液含有Fe(NO3)3、Cu(NO3)2 和过量HNO3。
(1)假设实验1剩余的17.2g固体全部为Cu,实验1生成NO:n(NO)=2.24L÷22.4L/mol=0.1mol
由于实验2剩余8.0g固体,且比实验1多生成2.24LNO,即多生成0.1molNO则根据实验2多消耗的9.2g铜生成的NO小于0.1mol可知,假设实验1剩余的17.2g固体全部为Cu不成立。
所以实验1后剩余的17.2g固体只可能为Fe、Cu,实验1后溶液中只有Fe(NO3)2(2分)
2n (Fe参与反应)=3n(NO)= 3×0.1mol
n (Fe参与反应)=0.15mol
每一份固体的质量为0.15mol×56g/mol+17.2g=25.6g
∴c(HNO3)= 4n(NO)/0.1L=4.0mol/L
(2)设每一份固体(25.6g)中含有的Fe、Cu物质的量分别为x、y
56x+64y=25.6g
3x+2y=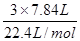
联立求解,解得x=0.2mol、y=0.225mol
其中含铜:m(Cu)= 0.225mol×64g/mol=14.4g
考点:考查了氧化还原的计算。


科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变血红色 溶液变血红色 |
固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
请填空:
(1)提出假设:
假设l:该固体物质是FeCl2
假设2:该固体物质是
假设3:该固体物质是
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:

(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的一项是
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.在苯酚溶液中滴加A溶液,呈紫色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)取100mLO.2mol/L FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是 (设溶液体积不变,不考虑水解因素。)
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=O.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=O.6mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=O.3mol/L
查看答案和解析>>
科目:高中化学 来源:2010-2011学年新疆农七师高级中学高三第二次模考化学试卷 题型:选择题
取10 mL 0.4 mol·L-1 FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物充分反应。下列叙述中一定不正确的是(设溶液体积不变,不考虑水解因素)
A.烧杯中有Cu无Fe,反应后溶液中c(Fe2+)≤0.6 mol·L-1
B.烧杯中有Fe无Cu,反应后溶液中c(Fe2+)=0.6 mol·L-1
C.烧杯中Fe、Cu均无,反应后溶液中c(Cl-)=1.2 mol·L-1
D.烧杯中Fe、Cu均有,反应后溶液中c(Fe2+)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(惟一还原产物)的体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
(1)该实验中所用稀硝酸的物质的量浓度为__________。
(2)第1次实验后剩余固体为__________,第2次实验后剩余固体为________。(均填写化学式)
(3)实验中每次所取混合物中铜的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com