
| A. | 催化剂可以改变化学反应速率 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 2molSO2与 1molO2一定能生成2molSO3 | |
| D. | 锌与稀硫酸反应时,加入少量铜粉能加快反应 |
科目:高中化学 来源: 题型:选择题
| A. | 科学家在宇宙深处发现了H3+与H3,二者互为同位素 | |
| B. | 焰色反应实验操作过程中,没有铂丝,也可以用光洁无锈的铁丝代替 | |
| C. | N2的结构式为N≡N,电子式为 | |
| D. | Na+的结构示意图 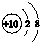 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠 | |
| B. | 在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 | |
| C. | Na2O不稳定,能继续被氧化,生成Na2O2 | |
| D. | Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
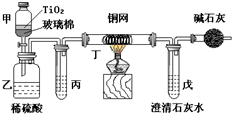 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI的浓度之比1:1:2 | |
| B. | H2、I2、HI的浓度保持不变 | |
| C. | 混合气体的密度保持不变 | |
| D. | 容器内气体的总压强不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 +Br2→BrCH2CH2CH2CH2CH2Br
+Br2→BrCH2CH2CH2CH2CH2Br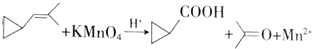
| A. | 环烷烃与烷烃都是饱和烃,所以具有相同的通式 | |
| B. | B所有的饱和烃都不能发生加成反应 | |
| C. | 可用溴水鉴别丙烯与环丙烷 | |
| D. | 可用酸性高锰酸钾溶液鉴别丙烯与环丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com