
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| 转换 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
2- 4 |
2- 7 |
| 10 |
| 11 |
| A、溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B、若用绿矾(FeS04?7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C、常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯在常温下与浓硝酸混合(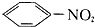 ) ) |
| B、将乙烯通入到水中(CH3CH2OH) |
C、甲苯与氯气在氯化铁催化下反应( ) ) |
| D、乙醇在银催化下加热与氧气反应(CH3CHO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
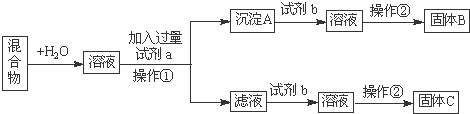
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.65 g |
| B、3.91 g |
| C、5.3 g |
| D、4.23g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )| A、该温度下此反应的平衡常数为3.2 |
| B、A的初始物质的量为4 mol |
| C、反应到达平衡时,放出的热量是193kJ |
| D、反应达平衡时,A的转化率为80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com