

分析 (1)属于芳香烃的有机物只含C、H两种元素,且含有苯环或稠环;
(2)属于醇类的物质应含有羟基,且羟基与苯环不直接相连;
(3)根据醛基的结构简式判断;
(4)属于羧酸的有机物应含有-COOH.
解答 解:(1)属于芳香烃的有机物只含C、H两种元素,且含有苯环或稠环,题中只有⑨符合,故答案为:⑨;
(2)属于醇类的物质应含有羟基,且羟基与苯环不直接相连,题中只有①符合,故答案为:①;
(3)醛基的结构简式为 ,则题中⑦含有醛基,故答案为:⑦;
,则题中⑦含有醛基,故答案为:⑦;
(4)羧基的结构简式为-COOH,则题中⑥⑧为羧酸,故答案为:⑥⑧.
点评 本题考查官能团的结构和性质,侧重于有机物化合物基础知识的考查,注意把握有机物的官能团的结构简式和有机物类别的判断,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中,HCO3-仅仅发生水解 | |
| B. | 在水溶液中,HCO3-仅仅发生电离 | |
| C. | 在水溶液中,HCO3-的水解程度要大于电离程度 | |
| D. | 在水溶液中,HCO3-的电离程度要大于水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:
如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:2 | B. | 2:3:2 | C. | 2:2:3 | D. | 3:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→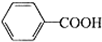 ↓+KCl
↓+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com