
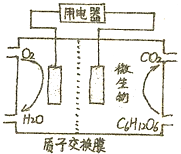
 糖类物质为很多生物生命活动提供能量.
糖类物质为很多生物生命活动提供能量.分析 (1)45g葡萄糖的物质的量为0.25mol,其完全氧化放热701KJ,则1 mol葡萄糖在体内完全氧化将放出热量2840kJ;
(2)燃料电池的构造为:燃料通入负极,氧气或空气通入正极;工作的过程中,阳离子移向正极,阴离子移向负极;
(3)电解100L某浓的硫酸铜溶液,当溶液PH=1时生成硫酸物质的量为$\frac{0.1mol/L}{2}×100L$=5mol,据电解硫酸铜的化学方程式可知,每生成1mol硫酸转移2mo电子,根据电子守恒计算需要葡萄糖的质量.
解答 解:(1)45g葡萄糖的物质的量为0.25mol,其完全氧化放热701KJ,则1 mol葡萄糖在体内完全氧化将放出热量2840kJ,反应的热化学方程式为C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2804kJ/mol,故答案为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g)△H=-2804kJ/mol;
(2)葡萄糖在负极失电子而被氧化,电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,原电池中阳离子从负极移向正极,
故答案为:C6H12O6+6H2O-24e-=6CO2+24H+;负;正;
(3)电解100L某浓的硫酸铜溶液,当溶液PH=1时生成硫酸物质的量为$\frac{0.1mol/L}{2}×100L$=5mol,据电解硫酸铜的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,可知,每生成1mol硫酸转移2mo电子,所以转移电子物质的量为10mol,据电极反应式C6H12O6+6H2O-24e-=6CO2+24H+可知,每转移24mol电子,需要葡萄糖的质量为180g,转移10mol电子,需要葡萄糖的质量为$\frac{180g×10}{24}$=75g,故答案为:75g.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a>0 | |
| B. | 每生成1mol水,转移8mol电子 | |
| C. | 氧化产物与还原产物的质量比为2:1 | |
| D. | N2H4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热生成氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量增加 | B. | 溶液的温度降低 | ||
| C. | 晶体不再溶解 | D. | 溶液的温度和质量都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成白色沉淀,加入足量氨水后沉淀消失 | |
| B. | 生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- | |
| C. | 生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl | |
| D. | 若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 1200℃灼烧Cu2S得Cu2O而不是CuO,可能是高温下+1价铜更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂焊接钢轨主要利用的是光能 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 1g氢气燃烧生成液态水,放出的热量为142.9 kJ,故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com