
【题目】用NaCl固体配制100mL2.0mol·L1NaCl溶液,请回答下列问题。
(1)用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__。
(2)用托盘天平称取NaCl固体的质量是__g。
(3)下列情况中,会使所配溶液浓度偏高的是__(填字母)。
A.定容时,俯视刻度线 B.转移液体时,有少量液体洒出
C.加蒸馏水超过了刻度线 D.没有洗涤烧杯和玻璃棒
【答案】100mL容量瓶 11.7 A
【解析】
(1)配制100mL2.0mol·L1NaCl溶液需要100mL容量瓶,用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和100mL容量瓶;
(2)根据n=cV计算溶质的物质的量,再有m=nM计算溶质的质量;
(3)根据c=![]() 进行分析。
进行分析。
(1)配制100mL2.0mol·L1NaCl溶液需要100mL容量瓶,用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和100mL容量瓶;
故答案为:100mL容量瓶;
(2)配制100mL2.0mol·L1NaCl溶液,NaCl的物质的量=cV=0.1L×2.0mol·L1=0.2mol,则NaCl的质量=nM=0.2mol×58.5g/mol=11.7g,
故答案为:11.7;
(3)A. 定容时,俯视刻度线,使所配置溶液溶液体积偏小,溶液浓度偏高,故A符合题意;
B. 转移液体时,有少量液体洒出,使所配溶液溶质的物质的量减少,溶液浓度偏低,故B不符合题意;
C. 加蒸馏水超过了刻度线,使所配置溶液溶液体积偏大,溶液浓度偏低,故C不符合题意;
D. 没有洗涤烧杯和玻璃棒,使所配溶液溶质的物质的量减少,溶液浓度偏低,故D不符合题意;
故答案选A。


科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液:K+、H+、SO42-、MnO4-
B.0.1 mol·L-1 NaClO溶液:Na+、NH4+、CO32-、SO32-
C.0.1 mol·L-1 FeCl3溶液:Ba2+、Al3+、SCN-、Cl-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
=0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是一种重要的化工原料,熔点为133 ℃、沸点为300 ℃,不溶于冷水,易溶于有机溶剂,广泛应用于医药、感光树脂和食品添加剂。实验室用苯甲醛和乙酸酐[化学式为(CH3CO)2O,有吸湿性,溶于水形成乙酸]制备肉桂酸的反应原理如下:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
过程中发生的副反应如下:
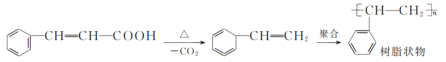
实验步骤如下:
步骤1:在三颈烧瓶中加入3 mL苯甲醛、8 mL乙酸酐和4.2 g K2CO3固体,搅拌,控制温度在150~170 ℃,加热回流45 min。
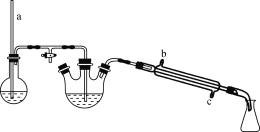
步骤2:向反应液中分批加入20 mL水,再加入Na2CO3固体调节溶液pH至8,然后进行水蒸气蒸馏。(装置如图)
步骤3:待三颈烧瓶中的剩余液体冷却后,加入活性炭,煮沸10~15 min,趁热过滤。
步骤4:将滤液冷却至室温,用盐酸酸化,待晶体析出完全后进行抽滤,用冷水洗涤晶体,干燥得到产品。
(1) 步骤1中,三颈烧瓶使用前必须干燥的原因是________;加入过量乙酸酐的目的是________。
(2) 步骤2中,水蒸气蒸馏时所用装置中玻璃管a的作用是________;冷凝管中冷凝水应从________(填“b”或“c”)口流入。
(3) 步骤3中,加入活性炭的目的是__________________________________。
(4) 步骤4中,抽滤所用的装置包括________、吸滤瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
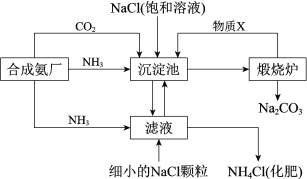
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
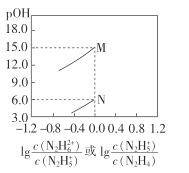
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
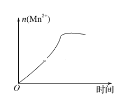
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
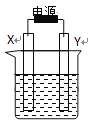
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件的溶液中,各组离子一定能够大量共存的是( )
A.使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.无色透明溶液中:K+、SO42-、MnO4-、H+
C.含有大量OH-的溶液中:Ba2+、Na+、NO3-、Cl-
D.可与锌反应放出氢气的溶液中:Na+、Ca2+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
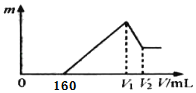
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com