
(1)在水蒸气中水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
水分子中的氧原子发生的是sp3杂化,每个水分子中的两个O―H键以及氧的两对孤对电子分别指向四面体的四个顶角。一个水分子的O―H键与另一个水分子中的氧原子的孤对电子所在轴在一条直线上,因此每个水分子最多与另外的四个水分子形成四个氢键,该水分子则拥有这四个氢键的一半,即每个水分子平均最多形成2个氢键。
(2)由以上分析知,冰中水分子间存在氢键,液态水分子中同样存在氢键,因此冰融化时氢键没有完全被破坏,冰的融化热要小于冰中氢键的作用能。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2011-2012学年浙江省杭州市萧山五校高一下学期期中联考化学试卷(带解析) 题型:填空题
下面是我们熟悉的物质:①O2②金刚石③NaBr ④H2SO4⑤Na2CO3⑥NH4Cl
⑦NaHSO4⑧Ne ⑨Na2O2⑩NaOH
(1)这些物质中,只含有共价键的是 ;只含有离子键的是 ;不存在化学键的 ;
(2)属于共价化合物的是 ;
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出电离方程式 ;NaHSO4熔融状态下电离,破坏了 键,写成电离方程式
。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州市萧山五校高一下学期期中联考化学试卷(解析版) 题型:填空题
下面是我们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl
⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 ;只含有离子键的是 ;不存在化学键的 ;
(2)属于共价化合物的是 ;
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出电离方程式 ;NaHSO4熔融状态下电离,破坏了 键,写成电离方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
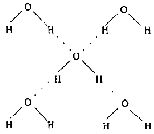
 (5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体――冰。
(5分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体――冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 KJ/mol,而冰的熔化热为5.0KJ/mol,说明
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com