
 Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是分析 A装置中反应生成二氧化碳,B装置产生二氧化硫,在C中与硝酸钠溶液反应,为检验产生的气体是NO还是NO2,利用二氧化碳排尽装置中空气,根据E中澄清石灰水变浑浊判断装置中空气排尽,根据D中气体颜色可以判断生成物.
(1)根据仪器的特征以及常见仪器的名称解答;设计装置A的目的排除装置中的氧气;
(2)将注射器里的空气注入集气瓶D中,看到无色气体变为红棕色,说明生成NO,二氧化硫被氧化为硫酸根;
(3)氮的氧化物、二氧化硫均有毒,可以污染空气,需要进行尾气处理.
解答 解:(1)仪器a具有长颈球形无活塞的玻璃仪器,为长颈漏斗,A装置中反应生成二氧化碳,CaCO3+2HCl=CaCl2+H2O+CO2↑,B装置产生二氧化硫,Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑.在C中与硝酸钠溶液反应,3SO2+2NaNO3+2H2O=Na2SO4+2NO+2H2SO4,为检验产生的气体是NO还是NO2,利用二氧化碳排尽装置中空气,根据E中澄清石灰水变浑浊判断装置中空气排尽,根据D中气体颜色可以判断生成物,所以设计装置A的目的是排除装置中的氧气,防止对实验产生干扰,
故答案为:长颈漏斗;排除装置中的氧气,防止对实验产生干扰;
(2)将注射器里的空气注入集气瓶D中,看到无色气体变为红棕色,说明生成NO,二氧化硫被氧化为硫酸根,反应方程式为:3SO2+2NaNO3+2H2O=Na2SO4+2NO+2H2SO4,
故答案为:3SO2+2NaNO3+2H2O=Na2SO4+2NO+2H2SO4;
(3)氮的氧化物、二氧化硫均有毒,可以污染空气,需要进行尾气处理,
故答案为:没有尾气处理装置.
点评 本题考查物质性质探究实验、物质组成的测定等,是对学生综合能力的考查,关键是原理的理解,较好的考查学生分析解决化学问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ca2+的结构示意图为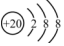 ,NH4Cl的电子式为 ,NH4Cl的电子式为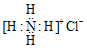 | |
| B. | 抗冰雪灾害时使用的融雪剂所含的氯化钠、氯化镁、氯化钙都属于盐 | |
| C. | 表示乙炔(CH≡CH)“燃烧热”的热化学方程式:CH≡CH(g)+$\frac{5}{2}{O_2}$(g)→2CO2(g)+H2O(g)+1256kJ | |
| D. | 质量数为16的氧原子:816O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
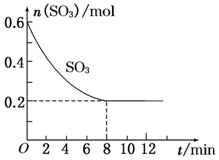 在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 增大体积 | C. | 加负催化剂 | D. | 补充 He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mol/L的醋酸溶液中加入镁条,产生气泡的速率先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| B | 常温下分别测等浓度的醋酸和氨水pH,发现二者的pH之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| C | 向均盛有2mL5%H2O溶液的两支试管中分别滴入0.2mol/LFe3+,和0.3mol/LCu2+溶液1mL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象 | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
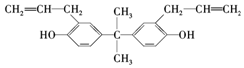 双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )| A. | 该化合物的化学式为C20H22O2 | |
| B. | 该化合物能与三氯化铁溶液发生显色反应 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1 mol双酚A最多可与4 mol Br2(溴水)发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 密度 | C. | 质量 | D. | H的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com