
用如图装置实验,下列叙述不正确的是( )
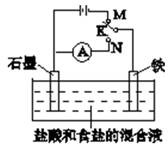
A.K与N连接时,组成原电池装置
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增小
D.K与M连接时,石墨电极的反应为:2Cl--2e-=Cl2↑
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
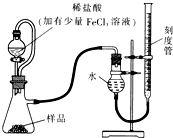 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:
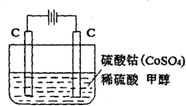 电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )
电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
原电池、电解(电镀)池是化学反应利用方面的典型事例,体现出能量之间的转换,受到越来越多的关注。按要求回答下列各个问题。
(1)南昌大学最近研发出一种新型纳米锂电池,已跻身国内领先地位。锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:![]() 正极:
正极:![]() 。
。
充、放电时电池中的变化简单表示为:![]() (a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(2)在正负极之间是固体电解质。固体电解质又称离子导体,在一定温度范围内具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样为离子的导电载体。下列物质能作为固体电解质的是 (填编号)。
①特种钢;②硝酸钾晶体;③银;④高纯度硅。
(3)实验室中用该类电池在铁棒上镀铜,当有lmol电子发生转移时,则正极产生物质的质量为 g。
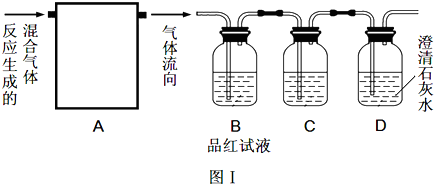
(4)为了使产品更耐腐蚀和美观,通常采用电镀的方式,但随之而来的是污染问题。某电镀厂处理有氰电镀的废水时,用Ti02作催化剂,用NaCl0将CN-离子氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成N2和C02;用如图装置实验,通过测定二氧化碳的量确定CN-的含量。将浓缩后含CN-离子200mL的污水与过量NaClO溶液的混合液,倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为_____________

②乙中除生成N2和C02外,还有HCl及副产物Cl2等。在上述装置中HCl和C12是如何被除掉的?______。
③实验后得到0.4吧沉淀,则浓缩后的污水中CN-的含量为 g/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com