
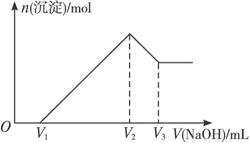
图11-1
(1)最初加入V1 mL NaOH溶液的作用是__________________________________________。
(2)盐酸的物质的量浓度是___________________________。
(3)若m g混合物中Al2O3与Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值改变________(填“会”或“不会”),(V2-V1)的取值范围是_________________________。
解析:这是一道涉及铝图象计算题。从图中看出氢氧化钠溶液体积0—V1时,无沉淀,故中和的是过量的盐酸,V1—V2氢氧根离子与Al3+、Fe3+结合形成沉淀,当在V2时沉淀完全,此时溶液中只有氯化钠,即盐酸的物质的量与氢氧化钠的物质的量相等,可借此求得盐酸的浓度,又可确定V2的值只与盐酸的用量有关,而与Al2O3、Fe2O3相对量无关。问题(3)求V2-V1的取值范围,这一段是沉淀Al3+、Fe3+,每摩离子均只消耗3 mol氢氧化钠,可利用极限法:若只含Al2O3,则Al3+物质的量为m/51 mol;若只含Fe2O3,则Fe3+物质的量为m/80 mol,从而确定氢氧化钠的物质的量及取值范围。
答案:(1)中和过量的盐酸 (2)V2×10-2 mol·L-1 (3)不会 3m/80×103<(V2-V1)<m/17×103


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2004年高考北京四中全真模拟试卷·化学 题型:013
将m g Al2O3,Fe2O3样品溶解在过量的100mL,pH=1的H2SO4中,然后向其中加入NaOH溶液使Fe3+,Al3+刚好完全转化为沉淀,用去NaOH溶液100mL,则NaOH溶液浓度为
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:
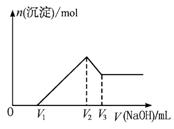
图1-3-17
若保持混合物总质量不变,Al2O3与Fe2O3按不同比例混合进行上述实验(其他条件不变),当![]() 变大时,关于V1、V2、V3的变化的判断正确的是( )
变大时,关于V1、V2、V3的变化的判断正确的是( )
A.V1变大 B.V2不变 C.V3变小 D.(V3-V1)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
A.0.2 mol/L B.0.05 mol/L C.0.1 mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com