
| A. | 钠和水反应 | B. | 铝热反应 | C. | 液氨气化 | D. | 镁条燃烧 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),以此解答该题.
解答 解:A.钠和水反应时钠熔化呈闪亮的小球,说明为放热反应,故A不选;
B.铝热反应为放热反应,停止加热后可继续进行,故B不选;
C.同种物质,气体能量高于液态,则液氨气化需吸收能量,故C选;
D.镁条燃烧释放出大量的能量,为放热反应,故D不选.
故选C.
点评 本题考查化学中吸热或放热问题,为高频考点,侧重考查双基知识,熟记吸热或放热的判断规律是正确解答此类题的关键,对于特殊过程中的热量变化的要熟练记忆.难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
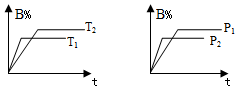 已知某可逆反应:aA(g)+bB (g)?cC(g) 在密闭容器中进行反应,如图所示,反应在不同时间t、温度T和压强p与反应物B在混合物气体中物质的量百分含量(B%)的关系曲线:由曲线分析出:(填写<、>或=)
已知某可逆反应:aA(g)+bB (g)?cC(g) 在密闭容器中进行反应,如图所示,反应在不同时间t、温度T和压强p与反应物B在混合物气体中物质的量百分含量(B%)的关系曲线:由曲线分析出:(填写<、>或=)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
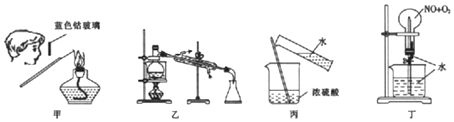
| A. | 通过图甲操作进行钾元索的焰色反应实验 | |
| B. | .用图乙装置制取蒸馏水 | |
| C. | 通过图丙操作将浓硫酸稀释为稀硫酸 | |
| D. | .用图丁装里进行喷泉实验,其中n(NO):n(O2)=4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Y)<r(X)<r(W)<r(Z) | |
| B. | 元素Z的最高价含氧酸的酸性比W的强 | |
| C. | 元素Y、W的离子具有相同的电子层结构 | |
| D. | Z的简单气态氢化物的热稳定性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 现象 | 解释 | |
| A | 铝箔插入稀HNO3中,无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
| B | 苯酚中滴加浓溴水,溶液酸性明显增强 | 可能发生了取代反应 |
| C | 某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
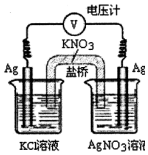 实验室利用如图所示装置,通过测电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
实验室利用如图所示装置,通过测电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 该装置工作时电能转化为化学能 | |
| B. | 左池中的电极增重比右池中电极更大 | |
| C. | 盐桥中的K+向左池方向移动 | |
| D. | 总反应为Ag+(aq)+C1-(aq)=AgCl(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2O在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 氧化产物与还原产物的物质的量之比为1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com