
分析 (1)根据构造原理写出其核外电子排布式;
(2)根据价层电子对互斥理论确定其空间构型;
(3)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,同主族自上而下电离能降低;
(4)根据价层电子对互斥理论判断C原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,如果价层电子对个数是4,则C原子采用sp3杂化,如果价层电子对个数是3,则C原子采用sp2杂化,如果价层电子对个数是2,则C原子采用sp杂化;原子核外电子运动状态和该原子的核外电子数相等,据此分析解答;
(5)在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,含有的2个π键;
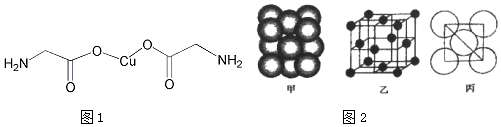
(6)根据图2可知,Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,据此判断Cu的配位数;铜晶体为面心立方最密集堆积,据此可计算出晶胞中含有铜原子数,根据公式ρ=$\frac{m}{V}$计算得出密度.
解答 解:(1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理知,其核外电子排布式为:1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
(2)PO43-中P原子的价层电子对=4+(5+3-4×2)=4,且不含孤电子对,所以其空间构型正四面体,
故答案为:正四面体;
(3)同周期随原子序数增大,第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于S的,故P>S;原因为P元素3p3半充满,较稳定,所以第一电离能大,
故答案为:P>S;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,C原子含有3个σ键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,C原子含有4个σ键,碳的杂化方式为sp3杂化;C原子具有6个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有6种不同的运动状态,
故答案为:sp3、sp2;6;
(5)在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,含有的2个π键,故1mol该配合物中含有的π键2mol,其数目为2NA=4.82×1024,
故答案为:4.82×1024;
(6)根据图2可知,Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,所以Cu的配位数为12;铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子半径为r=127.8pm=1.278×10-8cm,设晶胞的边长为d,则有$\sqrt{2}$d=4r,所以d=2$\sqrt{2}$r,所以晶体铜的密度为:ρ=$\frac{\frac{4×64}{{N}_{A}}}{{d}^{3}}$=$\frac{4×64}{{N}_{A}(2\sqrt{2}×1.278×1{0}^{-8})^{3}}$g/cm3,
故答案为:12;$\frac{4×64}{{N}_{A}(2\sqrt{2}×1.278×1{0}^{-8})^{3}}$.
点评 本题考查较为综合,涉及晶胞计算、核外电子排布、电离能、分子构型等内容,综合性强,难度较大,注意利用均摊法计算晶胞原子数目,试题培养了学生的分析、理解能力及综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(l)+B(l)═2C(g)△H | B. | 2A(g)+B(g)═2C(g)△H | C. | 2A(l)+B(l)═2C(l)△H | D. | 2A(g)+B(g)═2C(l)△H |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; .
. .
. .
. 和
和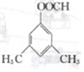 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的饱和HCOONa溶液、CH3COONa溶液的pH | HCOONa的pH<CH3COONa的pH | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向5ml 2mol•L-1NaOH溶液中加入1ml 1mol•L-1CuSO4溶液,振荡后加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | X | Y |
| Z | W |
| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8 | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、W | |
| D. | RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | |
| D. | HCO3-水解:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com