分析:A、氯化镁是离子化合物,由氯离子和镁离子构成.
B、氯原子未成键的孤对电子对未画出.
C、二氧化碳分子中碳原子与氧原子之间形成2对共用电子对.
D、氧化钠是离子化合物,有钠离子和氧离子构成.
解答:解:A、氯化镁是离子化合物,由氯离子和镁离子构成,氯化镁电子式为

,故A错误;
B、氯原子未成键的孤对电子对未标出,四氯化碳电子式为
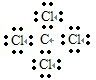
,故B错误;
C、二氧化碳是共价化合物,二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,达稳定结构,电子式为

,故C错误;
D、氧化钠是离子化合物,有钠离子和氧离子构成,电子式为,故D正确.
故选C.
点评:本题考查电子式的书写,难度不大,注意未成键的孤对电子对容易忽略.掌握电子式的书写:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷. 离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后.)拼在一起.对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写;
以共价键形成的物质,必须正确地表示出共用电子对数,并满足每个原子的稳定结构,共价化合物电子式的书写,一般为正价者在前.对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边.

 ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,故C错误;
,故C错误;

 B.四氯化碳:
B.四氯化碳:
 D.二氧化碳:
D.二氧化碳: