
常温下,下列各组粒子在指定溶液中能大量共存的是
A.pH=l的溶液中:CH3CH2OH、Cr2O72—、K+、SO42-
B.NaHCO3溶液中: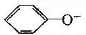 、CO32-、Br-、K+
、CO32-、Br-、K+
C.加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3-
D.C(Ca2+)=0.1 mol·L-1的溶液中:NH4+、SO42-、CH3COO-、Br-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省高三上学期开学考试化学试卷(解析版) 题型:选择题
化学与人们的日常生活密切相关,下列叙述正确的是
A.聚乙烯塑料的老化是由于发生了加成反应
B.乙酸乙酯在碱性条件下的水解反应称为皂化反应
C.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
D.棉、麻、合成纤维完全燃烧都只生成CO2和H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.17gOH-与19gH3O+所含质子数相等
C.标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等
D. 12g C和16g O所含的原子数不相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:计算题
有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L(标准状况)氧气在密闭容器中充分燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰充分吸收,浓硫酸增重3.6g,碱石灰增重4.4g,剩余气体体积为1.12L(标准状况)。回答下列问题:
(1)3g A燃烧后生成物的物质的量分别为:n(H2O)=_________,n(CO2)=_________,n(CO)=_________。
(2)通过计算确定A的分子式。
(3)写出A的所有可能的结构简式。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
工业废气的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3→N2+H2O。有关此反应,下列说法中错误的是
A.N2既是氧化产物又是还原产物
B.反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O
C.当x=1时,每生成2.5mol N2,被氧化的气体有3mol
D.当x=2时,有1mol气体被还原时,转移的电子为4mol
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期入学考试化学试卷(解析版) 题型:填空题
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。

(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:选择题
若氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A. 该氖原子的相对原子质量是12a/b
B. 该氖原子的摩尔质量是aNAg
C. Wg该氖原子的物质的量是 mol
mol
D. Wg该氖原子所含质子数是10W/a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com