
现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表:

据此,将甲和乙互相分离的最佳方法是
A.萃取 B.过滤 C.蒸馏 D.分液
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:填空题
(8分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子:K+ Na+ Cu2+ Al3+
阴离子:SO42- HCO3- OH- Cl-
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ____,D 。
(2)C可用作净水剂,用离子方程式表示其净水原理____ ___。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是


(4)在m mL b mol·L-1 C溶液中,加入等体积a mol·L-1 的E溶液。
当a≤3b时,生成沉淀的物质的量是 mol;
当3b<a<4b件时,生成沉淀的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
为了检验某固体物质中是否含有NH4+,下列组合正确的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①③ B.④⑤ C.①②③ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:填空题
(6分)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂,氧化产物是 ,此反应中,HCl表现的性质有酸性和______性。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
A.0.02 mol·L-1 B.0.05 mol·L-1
C.0.25 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
化学概念在逻辑上存在如下图所示关系,对下列概念相互关系的说法中正确的是

A.纯净物与混合物属于包含关系
B.化合物与电解质属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与化合反应属于并列关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:填空题
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)

(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
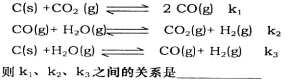
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:

根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
化工厂的设计是将实验室的研究成果转化为工业化生产的重要的基础工作。
(1)以硫铁矿为原料生产硫酸需经过 、 和 三个主要生产阶段。
(2)侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:

①索尔维制碱法的原理是 。(用化学方程式表示)
②侯氏制碱法与索尔维制碱法相比,优点是 。
③侯氏制碱法可以循环使用的物质有 。
(3)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com