
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
分析 盐酸过量、锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,以此解答该题.
解答 解:①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入醋酸钠固体,会和盐酸反应生成醋酸,氢离子浓度减小,但是物质的量不变,所以速率减慢,但是不影响产生H2总量,故⑥错误;
故选B.
点评 本题考查化学反应速率的影响元素,为高频考点,侧重于学生的分析能力的考查,难度中等,注意加入氧化铜、Fe粉对氢气总量的影响,是本题的易错点.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
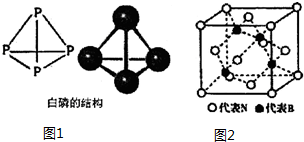
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
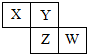
| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能是金属元素 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | 四种元素的原子有可能均能与氢原子形成18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只含共价键 | |
| C. | W和Z元素形成的化合物中只含极性键 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 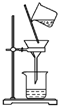 除去粗盐溶液中的不溶物 | B. | 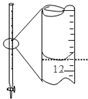 记录滴定终点读数为12.20ml | ||
| C. | 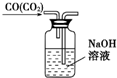 除去CO气体中的CO2气体 | D. | 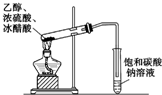 乙酸乙酯制备演示实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C4H12O2 | B. | C3H8O | C. | C2H6O | D. | C2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com