
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}×{10^{-18}}mol/L$ |
分析 A.25℃时,CuS的溶度积小于ZnS,二者阴阳离子比相同,说明溶解度小;
B.由FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,向物质的量浓度相同的FeCl2、CuCl2的混合液中加入少量Na2S,硫离子浓度小的先生成沉淀;
C.由Ksp可知,CuS溶度积小于FeS,除去某溶液中的Cu2+,加入FeS实现沉淀转化;
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,恰好反应时溶液中c(S2-)=c(Cu2+),根据CuS的溶度积常数(Ksp)为1.3×10-36计算.
解答 解:A、25℃时,CuS的溶度积小于ZnS,二者阴阳离子比相同,说明CuS溶解度小,故A错误;
B.由FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,向物质的量浓度相同的FeCl2、CuCl2的混合液中加入少量Na2S,$\sqrt{Ksp(CuS)}$更小,先生成CuS沉淀,故B错误;
C.CuS溶度积小于FeS,除去某溶液中的Cu2+,加入FeS实现沉淀转化,发生Cu2++FeS=CuS+Fe2+,但引入新杂质亚铁离子,应选ZnS作沉淀剂,故C错误;
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,恰好反应时溶液中c(S2-)=c(Cu2+),由Ksp为1.3×10-36,可知S2-能达到的最大浓度为$\sqrt{1.3}×{10^{-18}}mol/L$,故D正确;
故选D.
点评 本题考查溶度积常数的有关计算,为高频考点,把握溶度积计算方法、离子反应及溶解平衡等为解答的关键,侧重分析与应用能力、计算能力的综合考查,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
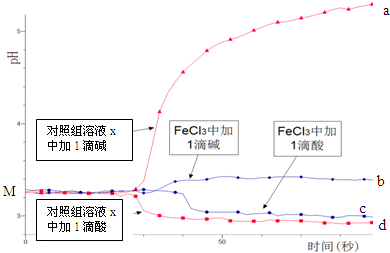
| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
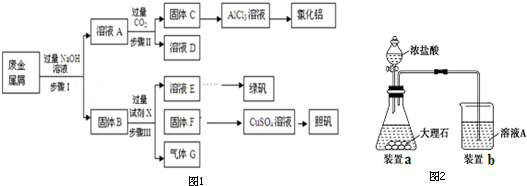
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
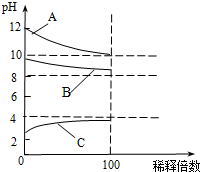 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com