
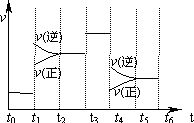
| A. | t2~t3和t3~t4时间段氨气的体积分数相等 | |
| B. | 氨气的体积分数最高的一段时间为t5~t6 | |
| C. | t4时刻改变的条件是降低温度 | |
| D. | t4~t5时间段平衡向正反应方向移动 |
分析 该反应为气体体积减小的反应,且为放热反应,由图象可知,t1时正逆反应速率均增大,且逆反应速率大于正反应速率,则平衡逆向移动;t3时正逆反应速率同等程度的增大,t4时正逆反应速率均减小,但逆反应速率大于正反应速率,则化学平衡逆向移动,以此来解答.
解答 解:该反应为气体体积减小的反应,且为放热反应,由图象可知,t1时正逆反应速率均增大,且逆反应速率大于正反应速率,则平衡逆向移动;t3时正逆反应速率同等程度的增大,t4时正逆反应速率均减小,但逆反应速率大于正反应速率,则化学平衡逆向移动,
A.t2-t3达到化学平衡状态,体积分数不变,t3-t4时间段化学平衡不移动,所以氨气的体积分数相等,故A正确;
B.由上述分析可知,t3时平衡不移动,t1、t4时改变条件反应均逆向移动,氨气的含量减少,则氨气的体积分数最高的一段时间为t0-t1,故B错误;
C.t4时正逆反应速率均减小,且逆反应速率大于正反应速率,平衡逆向移动,改变条件为降低压强,而降低温度平衡正向移动,故C错误;
D.t4-t5时间段,逆反应速率大于正反应速率,则化学平衡逆向移动,故D错误;
故选A.
点评 本题考查化学反应速率与化学平衡图象,为高频考点,把握图象中反应速率的变化及大小是解答本题的关键,注意逆反应速率大于正反应速率时平衡逆向移动,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 粘有油脂的试管可以用热的纯碱溶液洗涤 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇氧化得到 | |
| C. | 煤的气化、液化只发生物理变化 | |
| D. | 天然气作为化工原料主要用于合成氨和合成甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 |
| 向硬水中加入①(填序数),直到不再产生沉淀为止. |
| 继续向溶液中加入③(填序数),直到不再产生沉淀为止. |
| 将上述混合物过滤(填操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向盛有1mL2%的硝酸银溶液中逐滴加入2%稀氨水,边滴边振荡至最初产生的沉淀恰好消失为止 | 配制少量银氨溶液 |
| B | 向盛有2mL10%的硫酸铜溶液的试管中滴加0.5mL10%氢氧化钠溶液,混合均匀,滴入待检液,加热 | 检验某溶液中是否含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入3mol H2和1molN2,充分反应后可得到NH3分子数为2NA | |
| B. | 0.1mol/L Na2SO4溶液中含有Na+为0.2NA | |
| C. | 一定条件下,23 g Na与O2反应生成Na2O2时失去的电子数为NA | |
| D. | 标准状况下,22.4L SO3中含有的氯原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com