
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是 ( )
A. ①③②④ B. ③④②① C.①③④② D.③①②④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知:葡萄糖的燃烧热是2804.0kJ·mol-1,当它氧化生成1 mol水时,放出的热量
A.26.0kJ B.51.9 kJ C.155.8kJ D.467.3kJ
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三上学期第一次月考化学试卷(解析版) 题型:填空题
KMnO4是一种典型的强氧化剂。请回答下列问题:
(1)实验室中可用已知浓度的酸性高锰酸钾溶液滴定含Fe2+的溶液,从而测定溶液中Fe2+的浓度,离子反应方程式如下,请在空格内填上缺少的反应物,并配平:
_______-Fe2++_______MnO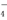 +_______
+_______ ===_______Fe3++_______Mn2++_______H2O
===_______Fe3++_______Mn2++_______H2O
(2)在稀硫酸中,MnO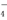 和H2O2也能发生氧化还原反应:
和H2O2也能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO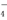 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
①写出该氧化还原反应的化学方程式:__________________。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应快速放出气体。其可能的原因是__________________
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
有关右图装置的叙述中,正确的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动[来
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
一定条件下可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次联考化学试卷(解析版) 题型:填空题
某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
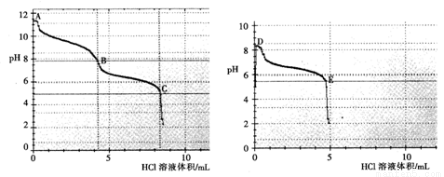
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次联考化学试卷(解析版) 题型:选择题
如图,缓慢通入O2,用水吸收NO2(假设每次通入的O2能完全反应)。下列说法正确的是()
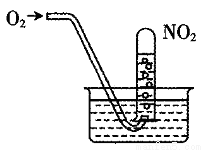
A.当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3
B.当试管气体不是红棕色时,说明NO2全部转化为HNO3
C.水槽内的水改为稀盐酸,有利于吸收NO2
D.水槽内的水改为稀NaOH溶液,有利于吸收NO2
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上第二次模拟化学试卷(解析版) 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。
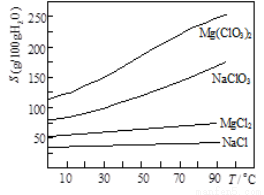
(1)加MgO后过滤所得滤渣的主要成分为 _____。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? ___。
(3)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为: ①取样,加入NaClO3饱和溶液充分反应,②蒸发结晶;③ ;④ ;⑤过滤、洗涤。
Mg(ClO3)2+2NaCl↓,请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为: ①取样,加入NaClO3饱和溶液充分反应,②蒸发结晶;③ ;④ ;⑤过滤、洗涤。
(4)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是___________________。
产品中Mg(ClO3)2·6H2O(其相对分子质量为299)含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点。此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(5)写出步骤2中发生的离子方程式_______________________。
(6)上述产品测定中需要检查是否漏液的仪器有_____________________。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏___________(填“大”或“小”)。
(7)产品中Mg(ClO3)2·6H2O的质量分数为 ______ 。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上期初化学卷(解析版) 题型:选择题
气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少?③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com