
【题目】如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )

A. B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B. 实验开始时应先将活塞E关闭
C. 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中
D. 取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色
科目:高中化学 来源: 题型:
【题目】工业上处理含Cr2O![]() 的酸性工业废水用以下方法:
的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)电解时的电极反应,阳极 , 阴极。
(2)写出Cr2O![]() 转变成Cr3+的离子反应方程式。
转变成Cr3+的离子反应方程式。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?。
(4)能否将Fe电极改成石墨电极?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2﹣和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 .
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 .
(3)X与Z中电负性较大的是 . Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是 , 此离子中含有的化学键类型是 , X﹣Z﹣X的键角109.5°.(填“>”“=”或“<”)(提示:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力).
(4)X与Y形成的化合物Y2X的晶胞如图.其中X离子的配位数为 , 以相距一个X离子最近的所有Y离子为顶点构成的几何体为 . 该化合物与MgO相比,熔点较高的是 . 
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为gcm﹣3 . (只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.实验室用下列有关装置先制取干燥、纯净的氯气,后进行有关性质实验。试回答下列问题。
(1)上述装置中各仪器从左至右的连接顺序为接接接接接接。
(2)E装置的作用是 , G装置的作用是 , D中的现象为 , B中的现象为
。
(3)写出下列反应的离子方程式:B中 , G中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。 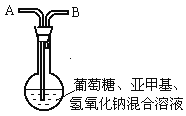
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
①从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
②在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
③为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2 , 都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置连接好仪器,观察下图,示意图正确的是( )
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 mol·L-1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是
A. 称量时,左盘高,右盘低 B. 定容时俯视读取刻度
C. 原容量瓶洗净后未干燥 D. 转移溶液时未洗涤烧杯2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法正确的是( )
A.所有原子都含有质子、中子和电子3种基本微粒
B.质子数决定元素的种类,中子数决定原子的种类
C.质子、中子和电子不可以进一步分成更小的微粒
D.1H、2H2、3H+不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)?
(3)方案三中的“冷却”应如何操作:;
理由是。
(4)方案四中计算碳酸钙纯度的公式为;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案:。
方案:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com