
| 0.018 |
| 2 |
| 0.02 |
| 2 |
| 1.0×10-10 |
| 0.001 |
| 0.02mol/L |
| 2 |
| 1.0×10-7×0.1 |
| 0.15 |
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、澄清的石灰水与盐酸反应 Ca(OH)2+2H+═Ca2++2H2 O |
| B、钠与水的反应 Na+2H2 O═Na++2OH-+H2↑ |
| C、铜片插入硝酸银溶液 Cu+Ag+═Cu2++Ag |
| D、大理石溶于醋酸 CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、Na2CO3 |
| D、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,继续加入2mL CCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+ |
| B、在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀 |
| C、燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
| D、蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、b>f |
| B、K(1000℃)>K(810℃) |
| C、915℃、2.0MPa时E的转化率为60% |
| D、该反应的△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
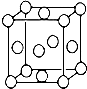 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、-283.01kJ?mol-1 |
| B、+172.51kJ?mol-1 |
| C、+283.1kJ?mol-1 |
| D、+504.00kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com