
【题目】下列说法正确的是![]()
A.化学反应能够制造新物质,同时也能制造出新的元素
B.煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏
C.在酿酒的过程中,葡萄糖可通过水解反应生成酒精
D.工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行多方面应用广泛,其中乙醇是较常见的有机物,它在人体内的主要代谢途径为如下:![]()
乙酸彻底氧化形成H2O、CO2同时释放出大量ATP。乙醇及其代谢产物部分对人体会造成伤害,所以青少年禁止饮酒。
(1)CH3CH2OH的官能团是__________(填“羟基”或“羧基”);
(2)乙醇在人体内的第一步代谢反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
(3)代谢过程中涉及到的CH3CHO、CH3COOH_________(填“易”或“难”)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
Al和FeO发生铝热反应的热化学方程式是______________________。某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合溶液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为_____mol,含溶质MgCl2的质量为_____g。
(2)该混合液中CaCl2的物质的量为_______mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.充入一定量的氮气,n(H2)不变
B.减小压强,n(CO2)增加
C.更换高效催化剂,CO的转化率增大
D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素类药物,对垂体促性腺激素的分泌有抑制作用,能改善体内激素的平衡状态,破坏肿瘤组织赖以生长发育的条件,对治疗前列腺癌和乳腺癌有明显的疗效,其结构如下:
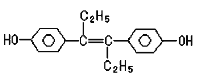
下列有关叙述中正确的是:
A.乙烯雌酚的分子式为C18H22O2B.乙烯雌酚可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与7mol Br2发生反应D.该有机物分子中一定有8个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是常见的气体污染物,消除NO废气是环境科学研究的热点课题。
(1)H2还原法
已知:①![]()
②![]()
则H2还原NO的热化学方程式为__________________________________。
(2)活性炭还原法
在容积为1L、温度恒定的密闭容中加入1mol NO和足量的活性炭,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
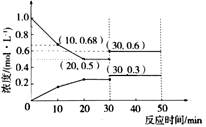
①0-10min内,用活性炭表示的平均反应速率为_________g/min。
②关于该反应的下列叙述正确的是________。
A.压强保持不变说明反应达到平衡
B.混合气体密度保持不变说明反应达到平衡
C.30min时,改变的条件可能是缩小容器体积
D.选择合适的催化剂,能提高NO的平衡转化率
③保持条件不变,若第30min时向容器中加入0.5mol CO2和0.5mol NO,则此时平衡___移动(填“正向”“逆向”或“不”)。判断的依据是_____________________________________。
(3)CO还原法
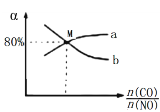
将总物质的量为2mol的CO与NO混合气体充入1L的密闭容器中,发生反应:2NO(g) + 2CO(g) ![]() 2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com