
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.分析 A-F六种元素中,除C外均为短周期元素,A原子最外层电子数是内层电子数的$\frac{1}{5}$,则A原子有3个电子层,最外层电子数为2,故A为Mg元素;B是形成化合物种类最多的元素之一,其单质为固体,则B为碳元素;C是生活中常见的金属,它有两种氯化物,相对分子质量相差35.5,结合C的某种氯化物的浓溶液可用于制作印刷电路板,可知C为Fe元素;D是地壳中含量最多的元素,则D为氧元素;E与D同主族,则E为硫元素;F与E同周期,且最外层电子数等于电子层数,处于第三周期,最外层电子数为3,则F为Al元素,据此解答.
解答 解:A-F六种元素中,除C外均为短周期元素,A原子最外层电子数是内层电子数的$\frac{1}{5}$,则A原子有3个电子层,最外层电子数为2,故A为Mg元素;B是形成化合物种类最多的元素之一,其单质为固体,则B为碳元素;C是生活中常见的金属,它有两种氯化物,相对分子质量相差35.5,结合C的某种氯化物的浓溶液可用于制作印刷电路板,可知C为Fe元素;D是地壳中含量最多的元素,则D为氧元素;E与D同主族,则E为硫元素;F与E同周期,且最外层电子数等于电子层数,处于第三周期,最外层电子数为3,则F为Al元素.
(1)A为Mg元素,处于周期表中第3周期ⅡA族,A与E形成的化合物为MgS,其电子式是 ,
,
故答案为:第3周期ⅡA族; ;
;
(2)氯化铁溶液与铜反应生成氯化亚铁、氯化铜,反应离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)碳与水蒸气在高温条件下生成CO与氢气,反应方程式为:C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2,
故答案为:C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2;
(4)氯化铝溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,C、D形成的相对分子质量为160的化合物为Fe2O3,与Al再高温下发生铝热反应生成Fe与氧化铝,反应化学方程式是:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,
故答案为:Al3++3H2O?Al(OH)3+3H+;2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3;
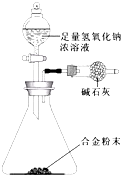
(5)①Mg与Al形成的合金是工业上重要的材料.某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中Mg元素的含量,该原理是根据反应前后装置的质量差测定生成氢气的质量,根据合金的质量与生成氢气的质量计算合金中各金属的质量,进而计算Mg的含量,故实验需要测定三个物理量:合金的质量m、反应前装置和药品的总质量、反应后装置和药品的总质量,
故答案为:反应前装置和药品的总质量;反应后装置和药品的总质量;
②生成氢气的质量为(a-b)g,令合金中Mg的质量分数为x,则Al的质量分数为(1-x),Mg的质量为mxg,Al的质量为m(1-x),根据电子转移守恒有:$\frac{mx}{24}$×2+$\frac{m(1-x)}{27}$×3=$\frac{(a-b)}{2}$×2,
解得x=$\frac{4m-36a+36b}{m}$,
故答案为:$\frac{4m-36a+36b}{m}$.
点评 本题考查结构性质位置关系、化学实验等,难度中等,推断元素是解题的关键,(5)为易错点、难点,注意根据装置图理解实验原理.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用作木材的防火剂 | |
| B. | Na2O2可用于潜水员的呼吸面具中的供氧剂 | |
| C. | 对“地沟油”蒸馏可以获得汽油 | |
| D. | 石英具有很好的导光性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HNO3═NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com