
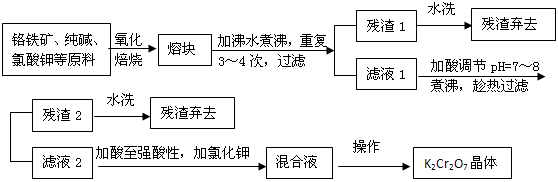

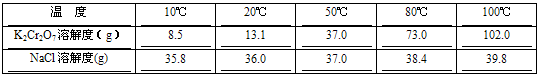
科目:高中化学 来源: 题型:
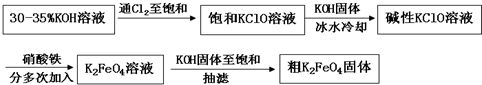
查看答案和解析>>
科目:高中化学 来源: 题型:038
氨氧化法可制得50%的硝酸,加脱水剂可进一步制备90%硝酸,两种产物的质量比![]() (
(![]() 分别为50%的硝酸溶液和90%的硝酸溶液质量),若以17t液氨为原料生产硝酸。
分别为50%的硝酸溶液和90%的硝酸溶液质量),若以17t液氨为原料生产硝酸。
(1)导出理论所需水量(yt)与质量比(x)的关系式(假定NH3的转化率为100%)。
(2)根据导出的关系式,求出只生产50%的硝酸所需水的质量和只生产90%的硝酸所需水的质量(t)。
(3)质量比(x)为多少时,进出水的质量保持平衡,此时两种产品的总质量为多少t?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)导出理论所需水量(yt)与质量比(x)的关系式(假定NH3的转化率为100%)。
(2)根据导出的关系式,求出只生产50%的硝酸所需水的质量和只生产90%的硝酸所需水的质量(t)。
(3)质量比(x)为多少时,进出水的质量保持平衡,此时两种产品的总质量为多少t?
查看答案和解析>>
科目:高中化学 来源: 题型:
氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比![]() =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com