
| A. | 以焦炭和二氧化硅为原料生产单质硅 | |
| B. | 以氨气为原料生产硝酸 | |
| C. | 电解氯化镁溶液生产金属镁 | |
| D. | 电解熔融氯化钠生产金属钠 |
分析 A.碳与二氧化硅在高温下反应生成硅;
B.氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸;
C.电解氯化镁溶液得到氢氧化镁、氢气和氯气;
D.活泼金属采用电解熔融盐或氧化物的方法冶炼,钠属于活泼金属,工业上采用电解熔融氯化钠的方法冶炼;
解答 解:A.碳与二氧化硅在高温下反应生成硅,方程式::SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑,故A正确;
B.氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,工业上用氨气制备硝酸,故B正确;
C.电解熔融的氯化镁可以来制取金属镁,故C错误;
D.钠是活泼金属,工业上采用电解法冶炼,2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故D正确;
故选:C.
点评 本题考查了物质的制备方法,熟悉二氧化硅、氨气的性质、金属冶炼与金属活泼性的关系是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
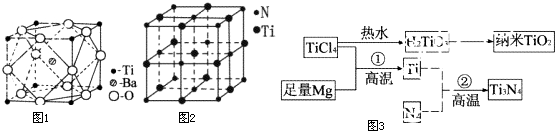
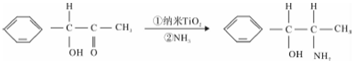
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
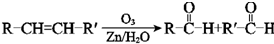
.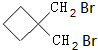 +CH2(COOC2H5)2+2C2H5ONa→
+CH2(COOC2H5)2+2C2H5ONa→ +2NaBr+2C2H5OH.
+2NaBr+2C2H5OH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
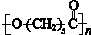 .其合成路线如下.
.其合成路线如下.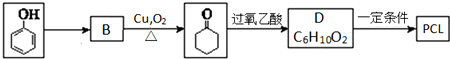

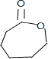 .上述生成D的反应类型是氧化反应.
.上述生成D的反应类型是氧化反应.
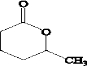 .
.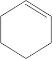 、XOHCCH2CH2CH2CH2CHO.
、XOHCCH2CH2CH2CH2CHO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g 18O2 中含有NA个氧原子 | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com