
【题目】高铁酸钾(K2FeO4)是一种高效净水剂.已知:K2FeO4 易溶于水,其溶液呈紫色、微溶于浓KOH 溶液,在0℃~5℃的强碱性溶液中较稳定.某小组同学用下图装置制备并探究
K2FeO4 的性质.制备原理:
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)
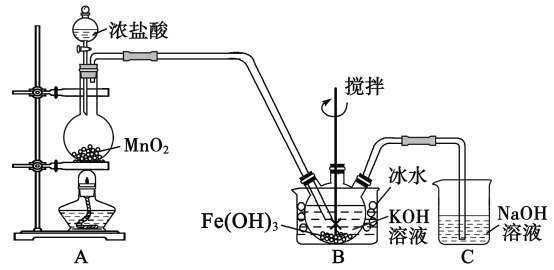
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是____________________,此装置存在一处明显缺陷,请指出____________。
(4)K2FeO4 粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_____________________。
(5)查阅资料知,K2FeO4 能将 Mn2+氧化成 MnO4-.该小组设计如下实验进行验证:
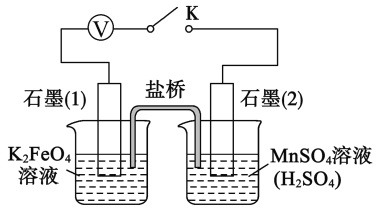
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色.检验左侧烧杯溶液呈黄色的原因,需要的试剂是__________。写出K2FeO4 氧化Mn2+ 的离子方程式: ___________________.
【答案】圆底烧瓶 吸收多余的氯气,防止污染环境 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCl的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) 5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O
MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCl的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) 5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O
【解析】
根据物质的制备、分离和提纯实验原理分析解答;根据离子方程式的书写规则分析解答。
(1)A装置是反应装置生成Cl2,B装置是Cl2制备高铁酸钾,C装置是尾气处理装置,则盛放二氧化锰的仪器是圆底烧瓶,装置C的作用是吸收未反应的Cl2;
故答案为:圆底烧瓶,吸收多余的氯气,防止污染环境;
(2)装置A 是用浓盐酸与MnO2共热制备Cl2,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)从已知条件可知,K2FeO4在0℃~5℃的强碱性溶液中较稳定,所以实验时采用冰水浴的原因是K2FeO4在0℃~5℃环境中稳定,防止副反应发生,此装置存在一处明显缺陷,是缺少除Cl2中混有的HCI的装置;
故答案为:K2FeO4在0℃~5℃环境中稳定,防止副反应发生;缺少除Cl2中混有的HCl的装置;
(4)K2FeO4 粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤是由于K2FeO4 易溶于水,不能用水洗涤,使用乙醇洗涤是为了减少产品损失,易于干燥;
故答案为:减少产品损失,易于干燥;
(5)由题意可知,K2FeO4作氧化剂,得到电子,即石墨(1)作阴极,阴极FeO42-得到电子后生成Fe3+,检验Fe3+可以选用KSCN试剂,石墨(2)作阳极,Mn2+失去电子生成MnO4-,离子方程式为:5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O,
故答案为:硫氰酸钾溶液(KSCN溶液),5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O。


科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业提碘的主要方法之一。其流程如下:
![]()
完成下列问题:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向______________。
(2)流程中I2碘经过吸附,转化为I-、IO3-再转化为I2的过程,这样做的目的是_______。
(3)反应②发生时,由于碘在水中溶解度不大,溶液底部有固体生成;由于反应放热,有时溶液上方产生_____(填颜色)的气体。因此,反应②需要在______条件下进行。
(4)实验室从反应②所得溶液提取碘,可加入CCl4_______(填操作名称)碘,即把碘从水溶液中提取出来,并用________(填仪器名称)分离两种溶液。
(5)活性炭所吸附的I2也可以用NaHSO3将其转变为I-,该反应的氧化产物为_______(填微粒符号)。
已知NaHSO3溶液显弱酸性,试从平衡的角度解释原因____________。
向0.1mol/L的NaHSO3溶液中加入氨水至中性,请判断:c(Na+)____c(SO32–)+ c(HSO3–)+ c(H2SO3)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇结构式为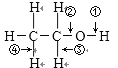 ,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
A. 与钠反应时断裂①键 B. 发生消去反应时断裂②④键
C. 发生催化脱氢反应时断裂①③键 D. 与乙酸发生酯化反应时断裂②键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
(1)基态硫离子价层电子的轨道表达式为___________,其电子填充的最高能级的轨道数为___________。
(2)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为___________,原因是___________。
(3)方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)=H2[PbCl4]+H2S↑,则H2[PbCl4]中配位原子是_________,第一电离能I1(Cl)___________I1(S)(填“>”、“<”或¨=”),H2S中硫的杂化方式为_______,下列分子空间的构型与H2S相同的有___________。
A.H2O B.SO3 C.O3 D.CH4
(4)方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的___________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为___________nm。
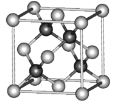
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一数值x来表示,若x越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的x值:

(1)通过分析x值的变化规律,确定N、Mg的x值范围: ____<x(N)<_____;_____<x(Mg)<_____。
(2)推测x值与原子半径的关系是_______________________________。
(3)某有机物结构式为C6H5SONH2,在S—N中,你认为共用电子对偏向谁?__________(写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是____________。
(5)预测元素周期表中,x值最小的元素位置____________________(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氢气合成氨气的原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)用太阳能分解水制备H2是一项新技术,其过程如下
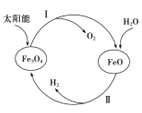
已知:2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ·mol-1 2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.8kJ·mol-1
①过程Ⅱ的热化学方程式是____________________________________.
②整个过程中,Fe3O4 的作用是________________________.
(2)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示.

①下列有关说法正确的是_______________________
A 由b点到c点混合气体密度逐渐增大
B 达到平衡时,2v正(H2)=3v逆(NH3)
C 平衡时,通入氩气平衡正向移动
D 平衡常数,ka<kb=kc
②T1 温度时,0-15min内v(H2)=___________ mol·L-1·min-1.
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k 为速率常数,只与温度有关).温度由T1 调到T2,活化分子百分率 ______________(填“增大”“减小”或“不变”),k正增大倍数______________k逆增大倍数(填“大于”“小于”或“等于”).T1℃时,k正/k逆=__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2CH(CH3)CH3的名称为3一甲基丁烷
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)CH3互为同素异形体
C. ![]() 和
和![]() 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮氧化物的存在会破坏地球环境,人们一直在积极探索改善大气质量的有效措施。已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5kJ·mol-1
2NO(g) △H=+181.5kJ·mol-1
(1)氮氧化物是形成臭氧层空洞光化学烟雾、_______(列举一种)等大气污染现象的物质之一。
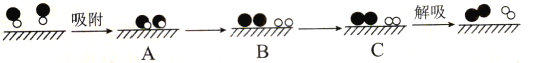
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______(填字母序号)。
(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2,仅发生反应2NO2(g)![]() 2NO(g)+O2(g) △H>0,达平衡时c(O2)=0.2mol·L-1,则该温度下反应的平衡常数为______。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1_____T2(填“>”或“<”)。
2NO(g)+O2(g) △H>0,达平衡时c(O2)=0.2mol·L-1,则该温度下反应的平衡常数为______。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1_____T2(填“>”或“<”)。
Ⅱ.氮氧化物(NOx)是电厂主要排放的污染物之一。工业上采用氨脱硝处理后排放,原理如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
②4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H2=akJ·mol-1;
5N2(g)+6H2O(g) △H2=akJ·mol-1;
当反应温度过高时,NH3发生氧化反应:
③4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
(4)反应②中的a=______。
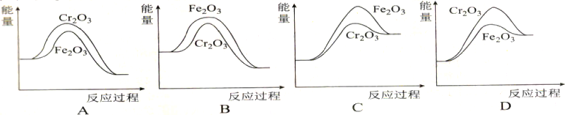
(5)反应②中,常用的催化剂有Cr2O3和Fe2O3,Cr2O3的催化效率更好一些。下列表示两种催化剂在反应②催化过程中的能量变化示意图合理的是______(填选项字母)。
Ⅲ.利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
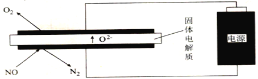
(6)阴极的电极反应式为______。
(7)消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)______。
(8)通过更换电极表面的催化剂可明显改善这一状况,利用催化剂具有______性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:
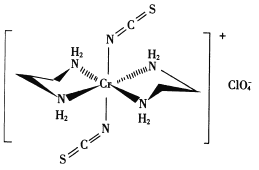
①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
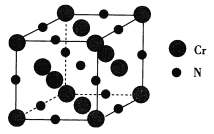
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com