
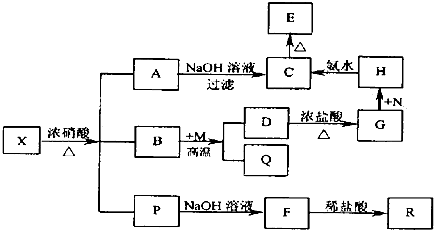
分析 根据题各物质转化关系,R是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,则F应为碳酸盐,则P中应含有碳元素,C为红褐色沉淀为Fe(OH)3,则A和H中都含有铁离子,所以A为Fe(NO3)3,B为常见的无色液体,应为H2O,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,B为H2O,则依据M为常见金属单质,与水反应生成Q和D,Q为常见非金属单质,所以Q为H2,H含有铁元素判断,M为金属Fe,D为Fe3O4,D与盐酸反应生成G为FeCl2和FeCl3,N为Cl2,G与N反应生成H为FeCl3,C加热生成E为Fe2O3,X与浓硝酸反应生成混合气体P应为CO2、NO2,据此答题.
解答 解:根据题各物质转化关系,R是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,则F应为碳酸盐,则P中应含有碳元素,C为红褐色沉淀为Fe(OH)3,则A和H中都含有铁离子,所以A为Fe(NO3)3,B为常见的无色液体,应为H2O,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,B为H2O,则依据M为常见金属单质,与水反应生成Q和D,Q为常见非金属单质,所以Q为H2,H含有铁元素判断,M为金属Fe,D为Fe3O4,D与盐酸反应生成G为FeCl2和FeCl3,N为Cl2,G与N反应生成H为FeCl3,C加热生成E为Fe2O3,X与浓硝酸反应生成混合气体P应为CO2、NO2,
(1)根据上面的分析可知,X的化学式为Fe3C,R为CO2,分子的空间构型为直线型,
故答案为:Fe3C;直线型;
(2)根据上面的分析可知,气体P的组成为CO2、NO2,
故答案为:CO2、NO2;
(3)D→G的离子反应方程式为Fe3O4+8H+═Fe2++Fe3++4H2O,
故答案为:Fe3O4+8H+═Fe2++Fe3++4H2O;
(4)M为金属Fe,M与钛构成的合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、M3+溶液中加入M至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+M+4H+═2Ti3+ (紫色)+M2++2H2O、②Ti3+(紫色)+M3++H2O═TiO2+ (无色)+M2++2H+、③2Fe3++Fe═3 Fe2+,
故答案为:2Fe3++Fe═3 Fe2+;
(5)X为Fe3C,X中的金属元素有0价、+2价两种化合价,X与稀硫酸反应的化学方程式为Fe3C+3H2SO4═CH4↑+H2↑+3FeSO4,
故答案为:Fe3C+3H2SO4═CH4↑+H2↑+3FeSO4;
(6)聚合硫酸铁是一种常见的净水剂,化学式为:[Fe2(OH)n(SO4)${\;}_{3-\frac{n}{2}}$]m(n>2,m≤10),其制备可由硫酸铁经水解后再聚合得到,其中聚合反应的原理为m[Fe2(OH)n(SO4)${\;}_{3-\frac{n}{2}}$]?[Fe2(OH)n(SO4)${\;}_{3-\frac{n}{2}}$]m,则硫酸M水解的化学方程式为2Fe2(SO4)3+2nH2O=2Fe2(OH)n(SO4)${\;}_{3-\frac{n}{2}}$+n H2SO4,
故答案为:2Fe2(SO4)3+2nH2O=2Fe2(OH)n(SO4)${\;}_{3-\frac{n}{2}}$+n H2SO4.
点评 本题考查了物质转化关系,物质性质的分析判断,根据反应现象和物质性质及元素守恒进行物质推断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>D>C | B. | B>D>A>C | C. | D>A>B>C | D. | D>B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
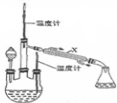 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁是第IIA族元素 | |
| B. | 第IA族元素全部是金属元素 | |
| C. | 氧族中含金属元素 | |
| D. | 第3周期中既有金属元素又有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素可形成X2Z和X2Z2两种常见共价化合物 | |
| B. | M与Z形成的化合物的分子式为M2Z3 | |
| C. | 工业上可用电解熔融的W的氯化物的方法制取W的单质 | |
| D. | Z元素对应的单质与W元素对应的单质在不同条件下反应产物可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
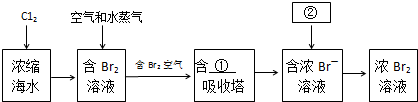
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com