
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
B
【解析】室温下,A中将等体积等浓度的HA和KOH混合(忽略体积变化),溶液呈碱性,说明该HA是弱酸,由于A-水解,所以c(K+)> c(A-),c(OH-)> c(H+),且水解程度微弱,A正确。B中溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),c(OH-)-c(H+)=c(K+)-c(A-)= Kw/10-9mol/L-10-9mol/L,故B错误;C.当等物质的量的酸和碱恰好反应时,溶液呈碱性,要使等体积的酸和碱混合后溶液呈中性,则酸的浓度应大于碱,根据物料守恒得c(A-)+c(HA)>0.1 mol/L,故C正确;D.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),中性溶液中水的电离较微弱,所以c(A-)>c(OH-),故D正确;答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++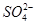 =BaSO4↓
=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH-+2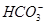 =CaCO3↓+
=CaCO3↓+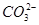 +2H2O
+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸: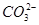 +H+=
+H+=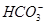
A.①②⑤ B.②③④⑤⑧ C.④⑤⑥⑦ D.②③⑧
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是

①CO2+OH-=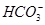 ②CO2+2OH-=
②CO2+2OH-=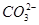 +H2O
+H2O
③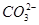 +Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2
+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2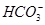
⑤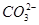 +CO2+H2O=2
+CO2+H2O=2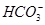
A.③① B.②⑤ C.⑤④ D.④②
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③
C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
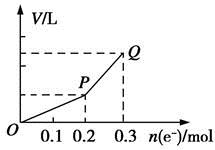
A.0.1 mol CuO B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是
_______(填序号)。
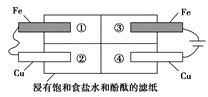
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2OCH3CH2OH+CH3COOH
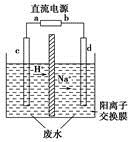
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入________(填化学式),电极反应式为________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
一定体积的溶质质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大1倍,溶液体积变为62.5 mL。则浓缩后溶液的物质的量浓度为
A.2.2 mol·L-1 B.4 mol·L-1
C.5 mol·L-1 D.6.25 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com