
科目:高中化学 来源: 题型:实验题
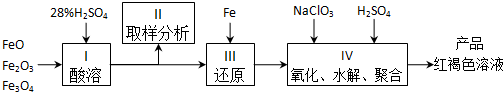
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
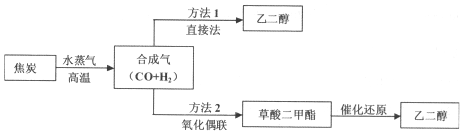
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氯原子的相对原子质量为$\frac{a}{b}$ | |
| B. | m g该氯原子的物质的量为$\frac{m}{a{N}_{A}}$mol | |
| C. | 该氯原子的摩尔质量为aNAg | |
| D. | a g该氯原子所含的电子数为17 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH | B. | CH3COOH | C. | C2H5OH | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别胶体与浊液(丁达尔效应) | B. | 高压除尘(电泳现象) | ||
| C. | 河海交汇处可沉积沙洲(聚沉) | D. | 喷雾剂的应用(布朗运动) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92 g NO2和N2O4混合气体含有的原子数为6 NA | |
| B. | 5.6 g金属铁与足量稀盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,ll.2 LSO3含有的分子数为0.5 NA | |
| D. | 25℃、101 kPa时,64 g SO2中含有的氧原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①和④ | D. | ③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
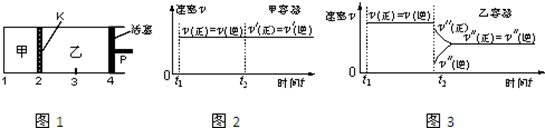
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com