
分析 I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
则依据盖斯定律计算①×$\frac{3}{2}$-②得到反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的热化学方程式得到反应的焓变;
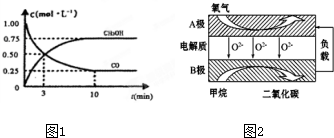
Ⅱ.(1)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动;
c.加入合适的催化剂,平衡不移动;
d.移出部分CO2,平衡向正反应移动;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动;
Ⅲ.(3)根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
(4)平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的$\frac{5}{8}$倍,据此判断反应的方向;
(5)由阴离子移动方向可知B为负极,负极上甲烷失电子发生氧化反应,甲烷被氧化生成二氧化碳和水:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,结合电子守恒计算消耗甲烷的体积.
解答 解:I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
则依据盖斯定律计算①×$\frac{3}{2}$-②得到反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5KJ/mol,
故答案为:23.5;
Ⅱ.(1)令平衡时CO的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以 $\frac{n+1}{1-n}$=4,解得n=0.6,则CO的平衡转化率为 $\frac{0.6mol}{1mol}$×100%=60%,
故答案为:60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,可以加快反应速率,但平衡不移动,故e错误;
故答案为:d;
Ⅲ.(3)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(4)反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的$\frac{5}{8}$倍,总物质的量=4×$\frac{5}{8}$=2.5mol,反应前后减少了1.5mol,即化学反应向着正反应方向进行,
故答案为:正;
(5)①燃料电池中燃料在负极发生氧化反应,甲烷失电子在熔融盐中生成二氧化碳气体,B极上的电极反应式为:CH4-8e-+402-=CO2+2H2O,
故答案为:CH4-8e-+402-=CO2+2H2O;
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体位氧气,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,电极反应为4OH--4e-=2H2O+O2↑,结合单质守恒和电极反应得到 CH4-8e-+402-=CO2+2H2O,CH4~8e-~2O2,则消耗甲烷物质的量0.25mol,标准状况下的体积=0.25mol×22.4L/mol=5.6L,故答案为:5.6;
点评 本题综合考查了化学平衡计算、等效平衡等,Ⅱ中等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题,思维量大,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
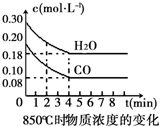 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
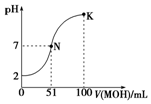 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | Al、Fe、Cu的单质放置在空气中均只生成氧化物 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com