
 某同学做如图实验,以检验反应中的能量变化.
某同学做如图实验,以检验反应中的能量变化.科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是形成酸雨的主要物质 | |
| B. | CO2导致温室效应,是一种大气污染物 | |
| C. | CO2(g)+C(s)$\stackrel{高温}{?}$2CO(g)△H>0,高温有利于该反应自发进行 | |
| D. | 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .请根据如图回答:
.请根据如图回答:
 .
. ;④
;④ .
. +C2H5OH
+C2H5OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入NaOH溶液中:CO2+2OH-=CO32 -+H2O | |
| B. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O | |
| C. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入过量的Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32 - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
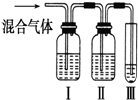 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤①② | B. | ①②⑤③④ | C. | ⑤④③②① | D. | ③④⑤②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com