
分析 (1)氯化铵溶液中铵根离子水解,结合水电离出的氢氧根离子促进水电离平衡正向进行,溶液显酸性;
(2)碳酸氢钠是强碱弱酸盐,溶液中碳酸氢根离子为弱酸的酸式根离子水解生成碳酸和氢氧根离子;
(3)FeCl3是强酸弱碱盐,铁离子水解而使其溶液呈酸性;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解生成氧化铁和水,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体;
(4)氯化钠和硝酸银反应生成氯化银和硝酸钠,观察到白色沉淀,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI.
解答 解:(1)氯化铵溶液中铵根离子水解,结合水电离出的氢氧根离子促进水电离平衡正向进行,溶液显酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)NaHCO3溶液呈碱性原因是碳酸氢根离子水解生成氢氧根离子,离子方程式:HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(3)FeCl3是强酸弱碱盐,铁离子水解生成Fe(OH)3和HCl而使其溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑+H2O,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+,Fe2O3,Fe3++3HCO3-=Fe(OH)3↓+3CO2↑+H2O;
(4)在2mL 0.1mol/L的NaCl溶液中,加入2mL 0.1mol/L的AgNO3溶液,二者反应生成氯化银和硝酸钠,观察到白色沉淀,离子反应为Ag++Cl-=AgCl↓,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI,观察到白色沉淀转化为黄色沉淀,离子反应为AgCl (s)+I-=AgI(s)+Cl-,
故答案为:白色沉淀;白色沉淀转化为黄色沉淀;AgCl (s)+I-=AgI(s)+Cl-.
点评 本题考查了盐类水解、离子方程式的书写,明确盐的类型即可判断盐溶液酸碱性,蒸干盐溶液时,如果生成难挥发性酸和强碱,蒸干时得到盐本身,如果水解生成挥发性酸和碱,蒸干时得到碱,题目较简单.


科目:高中化学 来源: 题型:解答题
 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为: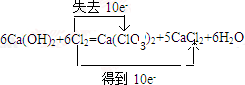 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由铁矿石炼成铁是化学变化,由生铁炼成钢是物理变化 | |
| B. | 生铁、钢的硬度都比纯铁的大 | |
| C. | 生铁和钢都含有铁元素,它们的性能和用途相差不大 | |
| D. | 生铁可以完全溶解在足量稀盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4固体 | B. | H2O | C. | 少量CuSO4溶液 | D. | 4 mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸上层析法分为上升纸层析法和径向纸层析法 | |
| B. | 纸上层析法适用于分离和检验化学性质十分接近的分子或离子 | |
| C. | 它利用试样中的各种离子随展开剂在滤纸上展开的速率不同而达到分离目的 | |
| D. | 只有有色离子的检验才能用纸上层析法,否则无法看到色斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117a3ρ | B. | $\frac{M}{{{N_A}{a^3}}}$ | C. | $\frac{234}{{{a^3}ρ}}$ | D. | $\frac{58.5}{{2{a^3}ρ}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com