
| 分类标准 | 导电的纯净物 | 氧化物 | 胶体 | 溶液 | 电解质 |
| 属于该类的物质 |
分析 依据物质分类和物质所属的类别分析判断,混合物是由两种或两种以上物质组成的;纯净物是由一种物质组成的;物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电,两种元素组成其中一种是氧元素的化合物为氧化物,分散质微粒直径为1-100nm形成的分散系,分散质微粒直径小于1nm形成的分散系为溶液,水溶液中或熔融状态导电的化合物为电解质.
解答 解:①液态HNO3 ②O2 ③固态K2O ④SO3 ⑤铜⑥熔融态的NaOH ⑦分散质粒子直径约为3.2×10-8m的分散系 ⑧氨水 ⑨食盐水⑩Fe2(SO4)3固体
熔融的氢氧化钠能电离出自由移动的离子,导电的纯净物是⑤⑥;氧化物为③④,胶体⑦,溶液为⑧⑨,电解质为①③⑥⑩;
故答案为:
| 分类标准 | 导电的纯净物 | 氧化物 | 胶体 | 溶液 | 电解质 |
| 属于该类的物质 | ⑤⑥ | ③④ | ⑦ | ⑧⑨ | ①③⑥⑩ |
点评 本题考查了物质分类方法,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
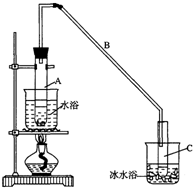 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.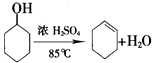 .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | H2SO4 | C. | NaH | D. | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com