
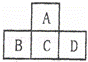
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
(1)写出下列元素的元素符号:A 、B 、D .
(2)A元素与氢元素形成的H2A化合物分子中,所含化学键为 键(填“离子”或“极性”或“非极性”),用电子式表示H2A的形成过程 , .
(3)A元素与E元素形成的化合物的化学式是 ,该化合物在物质分类中属于 氧化物.(填“酸性”,“碱性”或“两性”)
(4)向D元素与E元素形成的化合物的水溶液中滴加NaOH溶液,开始时,实验现象是 有 ,反应的离子方程式为 ;继续滴加NaOH溶液至过量,实验现象是 .
考点:
位置结构性质的相互关系应用.
分析:
A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x﹣8,B的质子数为x﹣1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x﹣8)+(x﹣1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,E元素的最高价氧化物既能与强酸反应又能与强碱反应,则E为Al,据此答题.
解答:
解:A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x﹣8,B的质子数为x﹣1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x﹣8)+(x﹣1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,E元素的最高价氧化物既能与强酸反应又能与强碱反应,则E为Al,
(1)根据上面的分析可知,A为O,B为P,D为Cl,
故答案为:O;P;Cl;
(2)A元素与氢元素形成的H2A化合物为水,所含化学键为极性键,用电子式表示H2O的形成过程为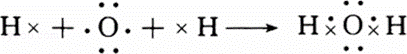 ,
,
故答案为: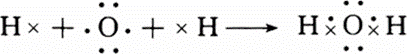 ;
;
(3)A元素与E元素形成的化合物的化学式是Al2O3,Al2O3属于两性氧化物,
故答案为:Al2O3;两性氧化物;
(4)向氯化铝的水溶液中滴加NaOH溶液,开始时,有氢氧化铝沉淀产生,所以实验现象是有白色沉淀出现,反应的离子方程式为 Al3++3OH﹣=Al(OH)3↓,继续滴加NaOH溶液至过量,氢氧化铝溶解到氢氧化钠中生成偏铝酸钠,实验现象是白色沉淀溶解,
故答案为:有白色沉淀出现;Al3++3OH﹣=Al(OH)3↓;白色沉淀溶解.
点评:
本题考查元素周期表和元素周期律,元素的推断是解答本题的关键,注意理解同主族元素质子数关系,注意利用电子守恒确定元素化合价,难度不大.


科目:高中化学 来源: 题型:
下列各溶液中,Na+浓度最大的是( )
|
| A. | 5L 1.2mol•L﹣1的Na2SO4溶液 |
|
| B. | 2L 0.8mol•L﹣1的NaOH溶液 |
|
| C. | 1L 1mol•L﹣1的Na2CO3溶液 |
|
| D. | 4L 0.5mol•L﹣1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知N≡N、N﹣H、H﹣H的键能分别为946kJ•mol﹣1、390.8kJ•mol﹣1、436.0kJ•mol﹣1.试根据盖斯定律,写出合成氨反应的热化学方程式 .
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,电极反应式为 ;
与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
若发现了116号元素,并知它是第ⅥA族元素,则下列说法中不正确的是( )
|
| A. | 其钠盐的化学式为Na2X |
|
| B. | 最高价氧化物对应水化物为碱 |
|
| C. | X是金属元素 |
|
| D. | X单质是能导电的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中,同主族元素从上到下,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”);同周期从左到右,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”).
查看答案和解析>>
科目:高中化学 来源: 题型:
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)⇌2HBr(g)△H<0,g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b.a与b的关系是()
A. a>b B. a=b C. a<b D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应可视为旧键的断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(KJ•mol﹣1)P﹣P:198 P﹣O:360 O=O:498 则反应P4(白磷)+3O2→P4O6 的反应热△H为()

A. +1638KJ•mol﹣1 B. ﹣1638KJ•mol﹣1
C. +126KJ•mol﹣1 D. ﹣126KJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列说法不正确的是()
A. 铝盐(明矾溶液)和铁盐(硫酸铁溶液)都有净水作用,两者的作用原理是相同的
B. 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
C. 0.1mol/L的CH3COONa溶液的pH约为9,说明CH3COOH是弱酸
D. 室温下向10mLpH=3的醋酸溶液中加入水稀释后,溶液中导电粒子的数目减少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子,彼此性质一定相似的是( )
A. 1s2与2s2的元素
B. M层上有两个电子与N层上有两个电子的元素
C. 2p上有一个未成对电子与3p上有一个未成对电子的元素
D. L层上有一个空轨道和M层的p轨道上有一个空轨道的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com