
| A. | 升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大 | |
| B. | 活化分子的碰撞一定是有效碰撞 | |
| C. | 增大反应物的浓度,活化分子百分数增加,反应速率加快 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
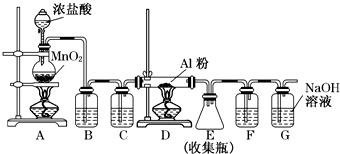
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.8 mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
某反应的△H=+100kJ·mol-1,以下有关该反应的叙述正确是_________
①正反应活化能小于100kJ·mol-1
②逆反应活化能一定小于100kJ·mol-1
③正反应活化能不小于100kJ·mol-1
④正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g)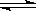 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
A .新平衡体系中,SO2和O2物质的量之比仍为2∶1
B .平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C .新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D .若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯代烷--臭氧空洞--皮肤癌患者增多 | |
| B. | 汽车尾气--光化学污染--咳嗽和气喘患者增多 | |
| C. | 人口增多--空气中CH4的浓度增大--温室效应 | |
| D. | 含磷洗衣粉--水体富营养化--水栖生物大量死亡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
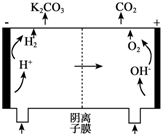 为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com