
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
【答案】B
【解析】
勒夏特列原理: 在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理用于解释化学平衡移动的方向,即化学平衡不移动,不能用勒夏特列原理解释。
A、Cl2+H2O![]() HCl+HClO,2HClO
HCl+HClO,2HClO![]() 2HCl+O2↑,HClO在光照条件下发生分解,HClO的浓度减小,使得Cl2与水反应的平衡正向移动,颜色变浅,可以用勒夏特列原理解释,A不符合题意;
2HCl+O2↑,HClO在光照条件下发生分解,HClO的浓度减小,使得Cl2与水反应的平衡正向移动,颜色变浅,可以用勒夏特列原理解释,A不符合题意;
B、H2+I2![]() 2HI,加压,由于反应前后气体体积不变,加压平衡不发生移动,不能用勒夏特别原理解释,而颜色变深,是由于体积减小,I2的浓度变大,颜色变深,B符合题意;
2HI,加压,由于反应前后气体体积不变,加压平衡不发生移动,不能用勒夏特别原理解释,而颜色变深,是由于体积减小,I2的浓度变大,颜色变深,B符合题意;
C、N2+3H2![]() 2NH3,增大压强,平衡正向移动,有利于氨气的生成,可以用勒夏特列原理解释,C不符合题意;
2NH3,增大压强,平衡正向移动,有利于氨气的生成,可以用勒夏特列原理解释,C不符合题意;
D、Fe3++3SCN-![]() Fe(SCN)3,加入NaOH,Fe3+与OH-反应生成Fe(OH)3沉淀,Fe3+浓度减小,平衡逆向移动,Fe(SCN)3减小,颜色变浅,可用勒夏特列原理解释,D不符合题意;
Fe(SCN)3,加入NaOH,Fe3+与OH-反应生成Fe(OH)3沉淀,Fe3+浓度减小,平衡逆向移动,Fe(SCN)3减小,颜色变浅,可用勒夏特列原理解释,D不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学历程为:
①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq)![]() NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
下列叙述中错误的是
A.反应的ΔH<0B.减少食盐的摄入,缓解疼痛症状
C.Ksp(NaUr)随着温度的降低而降低D.升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
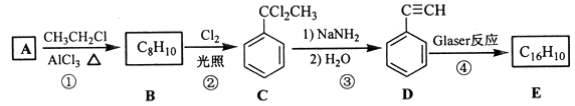
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)
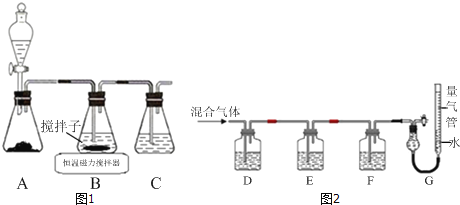
①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
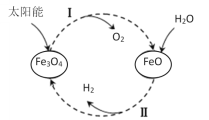
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是
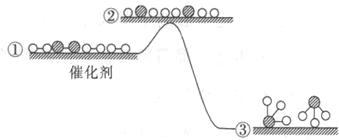
A.增大压强,①→②之间的能量差值会增大
B.合成氨的正逆反应的焓变相同
C.合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.有氧气参与的反应都是放热反应
B.热化学方程式既表示能量的变化,又表示物质的变化
C.若2CO2(g)![]() 2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
D.放热反应理论上都可以设计为原电池,将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)_______(填“>”“<”或“=”)v(逆),随后v(正)________逐渐(填“增大”或“减小”,下同),v(逆)逐渐_______,反应达到平衡时,v(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_______(填字母)。
A 其他条件不变时,压缩容器体积 B 其他条件不变时,升高反应体系温度
C 使用合适的催化剂 D 保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有0.01 mol Cu,a mol Cu2O、b mol CuO的混合物中滴加6 mol·L-1的稀硝酸溶液至10ml时,固体恰好完全溶解,得到标准状况下224mL气体(纯净物)。下列说法正确的是
A.反应过程中转移0.01 mol电子B.a:b=1:1
C.被还原的硝酸为0.06 molD.将少量铁粉投入该稀硝酸中能生成Fe(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com