
| A. | 微粒半径大小比较:r(N3-)>r(O2-) | |
| B. | N元素与氧元素形成的化合物只有五种 | |
| C. | 在该反应条件下,NH3的还原性弱于的H2O还原性 | |
| D. | 在该反应中,反应物的总能量小于生成物的总能量 |
分析 A.核外电子排布相同的离子,核电荷数越大离子半径越小;
B.N元素的化合价有+1、+2、+3、+4、+5,每种化合价都对应氧化物,其中+4价有2种氧化物;
C.元素的非金属性越强,对应的氢化物的还原性越弱;
D.为放热反应,反应物总能量较大.
解答 解:A.N3-、O2-的核外电子排布相同,核电荷数越大离子半径越小,则r(N3-)>r(O2-),故A正确;
B.N元素的化合价有+1、+2、+3、+4、+5,每种化合价都对应氧化物,其中+4价有2种氧化物,有NO2、N2O4,共6种,故B错误;
C.元素的非金属性越强,对应的氢化物的还原性越弱,NH3的还原性强于的H2O还原性,故C错误;
D.为放热反应,反应物总能量较大,故D错误.
故选A.
点评 本题考查较为综合,涉及氧化还原反应、化学反应与能量变化等知识,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
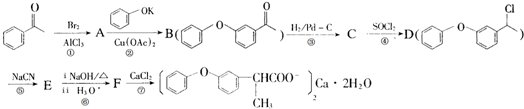
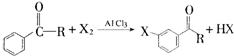
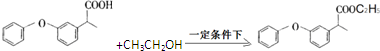
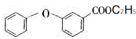
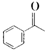 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、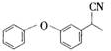 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 标准状况下,V L水含有的氧原子个数约为$\frac{V}{22.4}$NA | |
| D. | 1 mol Fe2+与足量的H2O2溶液反应,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
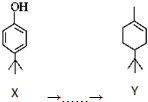 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$ CH2=CH2↑+Br-+H2O | |
| D. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
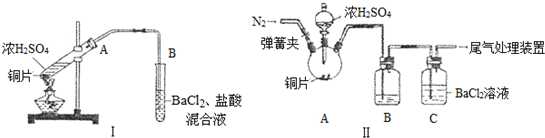
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com