

| 离子(0.1mol/L) | Cu2+ | Fe2+ | Fe3+ | 提供的药品(根据需要选择使用) |
| 氢氧化物开始沉淀pH | 4.7 | 7.0 | 1.9 | Cl2、NaOH溶液、CuO、Cu |
| 氢氧化物沉淀完全pH | 6.7 | 9.0 | 3.2 |
分析 (1)根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池,则电解质溶液甲是电极为硫酸锌,锌失电子为负极,Cu为正极,该电极上是铜离子得到电子;
(2)①铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,正极上氧气得电子,a为负极,负极上甲烷失电子;
②根据转移的电子守恒计算;
③结合2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,溶液中的Cu2+恰好完全析出计算反应后溶液的pH,电解硫酸铜溶液,要想恢复到与电解前的溶液相同,应加入CuO;
(3)①Fe3+有强氧化性,能把金属铜氧化成铜离子;根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
②先将将Fe2+转化成Fe3+;再根据图表条件溶液的pH值,三价铁离子沉淀完全后,进行过滤即可;
解答 解:(1)根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池,则锌失电子为负极,Cu为正极,该电极上是铜离子得到电子的还原反应,电极反应为Cu2++2e-=Cu,
故答案为:ZnSO4;Cu2++2e-=Cu;
(2)①铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②当铜电极的质量减轻6.4g,则n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,已知Cu电极的反应为Cu-2e-=Cu2+,所以转移电子为0.2mol,燃料电池中CH4-8e-+10OH-=CO32-+7H2O,则n(CH4)=$\frac{1}{8}$n(e-)=0.025mol,所以消耗的CH4在标准状况下的体积为0.025mol×22.4L/mol=0.56L;
故答案为:0.56;
③溶液中的Cu2+恰好完全析出,则析出的n(Cu)=0.2L×0.05mol/L=0.01mol,则生成硫酸0.01mol,氢离子为0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,pH=1;电解硫酸铜溶液,溶液中的Cu2+恰好完全析出后,要想恢复到与电解前的溶液相同,应加入CuO,
故答案为:1;b;
(3)①Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2FeCl3+Cu=CuCl2+2FeCl2,离子方程式为:2Fe3++Cu=Cu2++2Fe2+,设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,
故答案为:2Fe3++Cu=Cu2++2Fe2+;Cu;Fe3++e-=Fe2+;
②根据图表知,Fe3+沉淀需要的PH值较小,与铜离子沉淀时的PH值相差较大,所以首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气 作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在PH值3.2时三价铁离子完全沉淀,PH值4.7时铜离子开始沉淀,所以调节溶液的PH值至3.2-4.7;然后通过过滤除去生成的沉淀.
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2-4.7;③过滤(除去Fe(OH)3).
点评 本题考查盐类水解、原电池、电镀原理、电解池 中电子守恒的计算、离子除杂分析等,是对所学知识的综合考查,题目难度中等,电极过程中溶液PH计算、电极反应式书写为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题


 ),莽草酸分子中有3个手性碳原子.
),莽草酸分子中有3个手性碳原子.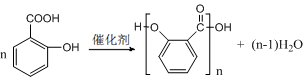 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
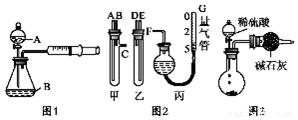
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2O和H2O | B. | O2和O3 | ||
| C. | ${\;}_{18}^{40}$Ar和${\;}_{20}^{40}$Ca | D. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中富集镁元素用NaOH沉淀法 | |
| B. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| C. | 从海水中提取溴单质的过程中用氯气做还原剂 | |
| D. | 将海带烧成灰,用水浸泡,乙醇萃取可以提取碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
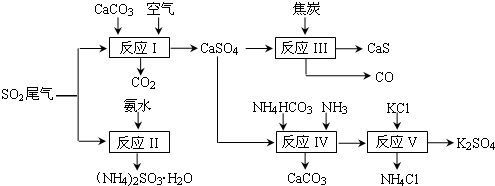
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C作氧化剂 | B. | Al2O3作还原剂 | ||
| C. | N2发生还原反应 | D. | AlN是氧化反应的产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com