

分析 I.要检验FeO,应该先将FeO转化为亚铁离子,因高锰酸钾溶液具有强氧化性,能氧化盐酸,所以不能用盐酸酸化高锰酸钾;
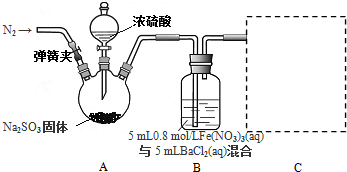
Ⅱ.(1)根据图示可知,盛放盐酸的装置为分液漏斗;测定样品中Fe2O3的质量分数,先根据CaCO3产生的CO2的质量计算出m(CaCO3),再根据样品质量计算出Fe2O3的质量分数;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的CO2尽可能彻底的赶入装置A中,使反应生成的CO2能够被Ba(OH)2溶液完全吸收;
(3)空气中含有CO2,会影响实验测定,而装置B中应该盛放NaOH溶液,从而吸收空气中的CO2,避免空气中的CO2影响测定结果;
(4)由于装置D生成的CO2中混有HCl和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的CO2的质量偏大,m(CaCO3)会偏大,样品中m(Fe2O3)偏小,Fe2O3的质量分数会偏小.
解答 解:I.要检验FeO,应该先将FeO转化为亚铁离子,亚铁离子具有还原性,酸性高锰酸钾溶液能氧化亚铁离子而褪色,高锰酸钾溶液具有强氧化性,能氧化盐酸,所以不能用盐酸酸化高锰酸钾,其检验方法为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO,
故答案为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO;
Ⅱ.(1)根据图示可知,盛放盐酸的装置为分液漏斗;测定样品中Fe2O3的质量分数,先根据CaCO3产生的CO2的质量计算出m(CaCO3),再根据样品质量计算出Fe2O3的质量分数,仪器连接顺序为:先将空气通入盛有NaOH溶液的装置B,以便除去空气中的CO2碳,然后利用空气将装置D中产生的CO2驱赶到装置A,利用CO2与Ba(OH)2生成的BaCO3沉淀的质量计算出m(CaCO3),由于空气中的CO2、水蒸气影响测定结果,需要在装置A后连接一个吸收CO2、水蒸气的装置C,所以装置连接顺序为:BDAC,
故答案为:分液漏斗;B;D;A;C;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的CO2尽可能彻底的赶入装置A中,使反应生成的CO2能够被Ba(OH)2溶液完全吸收,
故答案为:将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收;
(3)空气中含有CO2,会影响实验测定,而装置B中应该盛放NaOH溶液,从而吸收空气中的CO2,避免空气中的CO2影响测定结果,故d正确,
故答案为:d;
(4)由于装置D生成的CO2中混有HCl和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的CO2的质量偏大,m(CaCO3)会偏大,样品中m(Fe2O3)偏小,Fe2O3的质量分数会偏小,
故答案为:偏小.
点评 本题考查物质成分检验实验方案设计,为高频考点,明确物质性质是解本题关键,涉及亚铁离子检验、实验操作、误差分析等知识点,根据实验目的确定实验操作先后顺序,知道各个仪器作用,注意:不能用盐酸酸化高锰酸钾,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
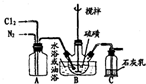 黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下:
黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下: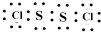 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NX2一定不与酸反应 | |
| B. | R2与水反应时,水是还原剂 | |
| C. | 简单离子的半径:M<Z<X | |
| D. | 最高价氧化物对应水化物的碱性:Z<M |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 结论或推论 | |
| A | 溴水中加入甲苯,振荡 | 水层几乎呈无色 | 甲苯与溴发生了反应 |
| B | 一小粒金属钠投入无水乙醇中 | 最后钠浮在液面上 | 密度:乙醇大于钠 |
| C | Fe(SCN)3溶液中滴入足量NaOH溶液 | 澄清后得到无色溶液 | Fe(OH)3悬浊液中滴加KSCN溶液后不显红色 |
| D | 在含Mn2+的草酸溶液中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液褪色较快 | 反应过程中,Mn2+一定氧化了草酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| C. | 肌醇 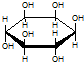 与葡萄糖 与葡萄糖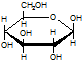 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的有机物(结构如图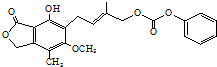 )最多能与含5.0 mol NaOH的水溶液完全反应 )最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com