
可用下图装置制取(必要时可加热)、净化、收集的气体是

A 铜和稀硝酸制一氧化氮 B 氯化钠与浓硫酸制氯化氢
C 锌和稀硫酸制氢气 D 硫化亚铁与稀硫酸制硫化氢
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
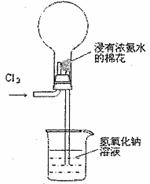 D.烧杯中的溶液是为了吸收有害气体
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
从绿色化学的理念出发,下列实验不宜用下图所示装置进行的是( )
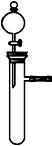
A.不同浓度的硝酸与铜反应 B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或盐酸反应 D.H2O2在不同催化剂作用下分解
查看答案和解析>>
科目:高中化学 来源: 题型:
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子 的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
Ag++2CN - = [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是 。
⑵水样预处理的装置如下图,细导管插入吸收液中是为了 。
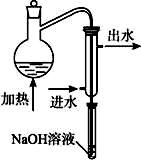
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.0100 0mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg·L-1的(以CN-计,计算结果保留一位小数)。
0mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg·L-1的(以CN-计,计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:

(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰.通过________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有___________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_______________________________
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________________(填写实验操作名称)

(3)本实验中制取次氯酸钠的离子方程式是:_______________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+_____KI+_____H2SO4====_____K2SO4+_____I2+______H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_______________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2SO32-====2I-+ SO42-。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________________。
②b中反应所产生的I2的物质的量是______________________________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关托盘天平的使用的叙述不正确的是( )
A.称量前先调节托盘天平的零点
B.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
C.用托盘天平只能称量至0.1g
D.称量时左盘放被称量物,右盘放砝码
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com