
在105℃时,1L某气态混合烃与9LO2混合,充分燃烧后恢复到原状态,所得气体体积为9L,下列各组混合烃中符合此条件的是
A.C2H4、C2H2 B.CH4、C2H4 C.C2H4、C3H4 D.CH4、C3H6
科目:高中化学 来源:2015-2016学年江苏省宿迁市高二下学期期末化学试卷(解析版) 题型:选择题
用32gCu与300mL12mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是
A.1.5mol B.1.8mol C.3.3mol D.3.6mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:选择题
化学与人类生活密切相关,下列说法错误的是( )
A.苯酚有一定毒性,可以作消毒剂和防腐剂
B.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
C.用食醋去除水壶中的水垢时所发生的是水解反应
D.木糖醇是一种新型的甜味剂,适合糖尿病患者的需要
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.羟基的电子式: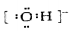
B.CH4分子的球棍模型:
C.乙烯的最简式:CH2
D.氟离子的结构示意图: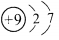
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德一中高一下期末化学试卷(解析版) 题型:实验题
下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
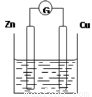
实验后的记录: ①正极的电极反应式:Zn―2e―=Zn2+ ②H+向负极移动 ③电子流动方向Zn→Cu ④在Cu处产生1.12L H2,则电路中一定有0.1mol电子通过 |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德一中高一下期末化学试卷(解析版) 题型:选择题
下列实验操作,不正确的是
A. 配制菲林试剂:先加入1~2mlNaOH溶液,再加入少量CuSO4溶液,振荡混合
B. 用热的NaOH溶液除去乙酸乙酯中混有的乙醇和乙酸
C. 配制银氨溶液:先加2%AgNO3溶液1~2ml,逐滴加入2%稀氨水至沉淀恰好溶解
D. 配制浓硫酸和浓硝酸的混酸溶液:先加入适量浓硝酸,再缓慢加入适量浓硫酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德一中高一下期末化学试卷(解析版) 题型:选择题
与CH3CH2CH=CH2互为同分异构体的是
A.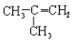
B.CH2=CH-CH=CH2
C.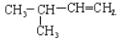
D.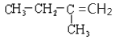
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高二下期末化学卷(解析版) 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
(1)Y在元素周期表中的位置为_________;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_________(写化学式)。
(3)X、Y、Z、M组成两种盐的溶液反应可产生MY2气体,写出其反应离子方程式:_________;
(4)M的氧化物与G的单质的水溶液均有漂白性,相同条件下,相同体积的该M的氧化物与Y的单质混合通入品红溶液,品红溶液_________(填褪色或不褪色),原因(用化学方程式表示)_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:简答题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH = a kJ ?mol-1
2Fe(s)+3CO2(g) ΔH = a kJ ?mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ ?mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ ?mol-1
则a = kJ ?mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
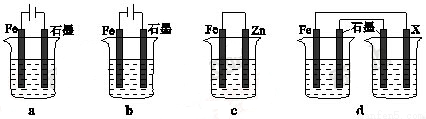
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com