

分析 钛铁精矿(FeTiO3)中加入稀硫酸,冷却、结晶、经充分反应后过滤,所得滤液中含有Ti4+、Fe2+、Fe3+等离子,滤渣为硫酸亚铁晶体,Ti4+水解生成H2TiO3和稀硫酸,过滤,得到沉淀B为H2TiO3,煅烧H2TiO3得到TiO2产品,
(1)FeTiO3与氢离子反应生成Fe2+、Ti4+、H2O;提高浸出率可从浓度、温度等影响化学反应速率的角度解答;
(2)根据流程分析可知副产物A为 FeSO4•7H2O,注意防止水解;
(3)加水稀释、加热均能促进TiO2+水解;
(4)根据流程可知稀硫酸循环使用;
(5)高温下,TiO2和碳粉、氯气反应生成TiCl4和CO;在高温下用金属镁还原TiCl4得到金属钛和氯化镁.
解答 解:钛铁精矿(FeTiO3)中加入稀硫酸,冷却、结晶、经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,滤渣为硫酸亚铁晶体,TiO2+水解生成H2TiO3和稀硫酸,过滤,得到沉淀B为H2TiO3,煅烧H2TiO3得到TiO2产品,
(1)FeTiO3与氢离子反应生成Fe2+、Ti4+、H2O,其反应的离子方程式为FeTiO3+6H+=Fe2++Ti4++3H2O,提高浸出率,可增大硫酸浓度、升高温度、边加硫酸边搅拦、增加浸出时间等,
故答案为:FeTiO3+6H+=Fe2++Ti4++3H2O;增大硫酸浓度/升高温度/边加硫酸边搅拦/增加浸出时间等;
(2)由流程分析可知副产物A为 FeSO4•7H2O,因亚铁离子易水解,且水解呈酸性,为防止水解,应保持较大的酸度,
故答案为:FeSO4•7H2O;防止Ti(SO4)2水解、减少FeSO4•7H2O的溶解量;
(3)加水稀释、加热均能促进Ti4+水解,所以滤液水解时往往需加大量水稀释同时加热,促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀,
故答案为:促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀;
(4)由流程可知:解钛铁精矿需要加入稀硫酸,TiO2+水解时生成H2TiO3和稀硫酸,则稀硫酸可以循环使用,符合绿色化学理念,
故答案为:水解得到的稀硫酸可以循环使用;
(5)高温下,TiO2和碳粉、氯气反应生成TiCl4和CO,其反应的方程式为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;在高温下用金属镁还原TiCl4得到金属钛和氯化镁,其反应的方程式为:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.
点评 本题考查了物质分离提纯的方法和流程分析判断,为高考常见题型,掌握物质性质和实验操作流程是解题关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子的球棍模型是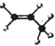 | B. | 2-氯甲苯的结构简式: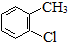 | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )| A. | TiCl4是还原剂 | |
| B. | 每消耗1mol Mg,Mg得到2mol电子 | |
| C. | TiCl4发生氧化反应 | |
| D. | 为防止Mg、Ti被氧化该反应可在氩气流中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
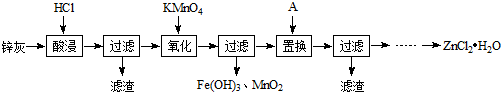
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 表1 | |||
| 编号 | 1 | 2 | 3 | 4 | |
| 盐酸体积/mL | 25.05 | 25.00 | 26.80 | 24.95 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com