
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
 CH3COOCH2CH2CH2CH3+H2O.
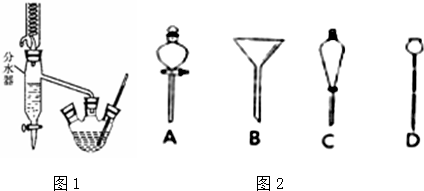
CH3COOCH2CH2CH2CH3+H2O.分析 (1)冷凝作用的仪器是冷凝管,水从下口进上口出;
(2)根据酯化反应原理酸脱羟基醇脱氢写出反应的化学方程式;
(3)根据外界条件对化学平衡的影响分析;
(4)乙酸丁酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应而被吸收;
(5)分液操作时下层液体从下口放出,上层液体从上口倒出;
(6)若从118℃便开始收集馏分此时的蒸气中含有醋酸和正丁醇,会收集到少量未反应的冰醋酸和正丁醇,导致获得的乙酸正丁酯质量偏大;
(7)先根据酸的量计算理论上酯的量,再根据水的量计算酯的量,实际上酯的量与理论值之比即为酯的产率.
解答 解:(1)了增强水的冷凝效果,冷水应该从冷凝管从下口a端管口通入,
故答案为:a;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与丁醇在浓硫酸作用下加热发生酯化反应生成乙酸丁酯和水,该反应为可逆反应,化学方程式为:CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O,
CH3COOCH2CH2CH2CH3+H2O,
故答案为:CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O;
CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①“不断分离除去反应生成的水”是因为该反应是可逆反应,减小生成物水的浓度,可以使该平衡正向移动,使用分水器分离出水,有利于平衡向正反应方向移动,提高反应产率,
故答案为:使用分水器分离出水,使平衡正向移动,提高反应产率;
(4)步骤②中得到的酯中含有未完全反应的挥发出的乙酸,用10%Na2CO3溶液洗涤有机层,该步操作的目的就是除去产品中含有的乙酸等杂质,
故答案为:除去产品中含有的乙酸等杂质;
(5)分液操作时,使用的漏斗是分液漏斗,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染,
故答案为:C;
(6)若从118℃便开始收集馏分此时的蒸气中含有醋酸和正丁醇,会收集到少量未反应的冰醋酸和正丁醇,因此会导致产率偏高,
故答案为:高;会收集到少量未反应的冰醋酸和正丁醇;
(7)正丁醇的质量=0.8 g/mL×18.5mL=14.8g;冰醋酸的质量=1.045g/mL×13.4mL=14.003g,
理论上14.8g正丁醇完全反应生成酯的质量为xg,需乙酸的质量是yg,
乙酸和正丁醇的反应方程式为CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
60g 74g 116g 18g
yg 14.8g xg
所以x=23.2 y=12g<14.003g
所以乙酸过量,乙酸正丁酯的产率=$\frac{15.1g}{23.2g}$×100%≈65%,
故答案为:65%.
点评 本题主要考查了乙酸乙酯的制备,题目难度中等,掌握乙酸乙酯的制备原理以及运用原理理解实验装置是解答的关键,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
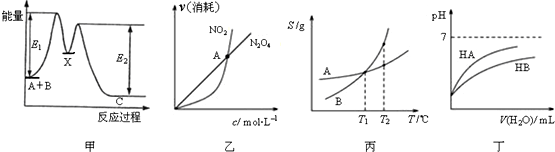
| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
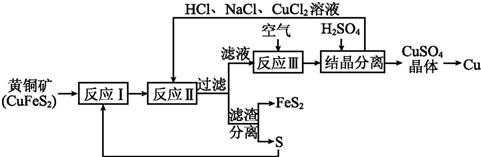
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
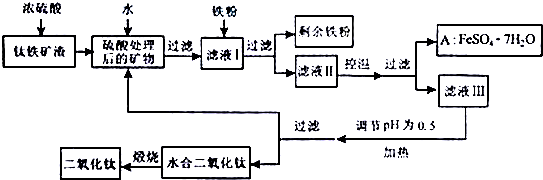
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com