
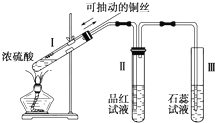
 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:分析 (1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)A.通过抽动铜丝可以控制Cu与浓硫酸的接触面积;
B.二氧化硫可以使品红溶液褪色;
C.二氧化硫能与氢氧化钠溶液反应;
D.应将试管中的溶液倒入水中,防止硫酸溅出伤人;
(3)①随反应进行,浓硫酸变稀,Cu不能与稀硫酸反应;
②硫酸、硫酸铜均匀钡盐反应得到硫酸钡沉淀,剩余的硫酸能与Fe、碳酸钠反应生成气体,据此检验是否有硫酸剩余.
解答 解:(1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A.通过抽动铜丝可以控制Cu与浓硫酸的接触面积,可以控制生成SO2的量,故A不选;
B.二氧化硫可以使品红溶液褪色,根据品红溶液是否褪色判断是否有二氧化硫生成,故B不选;
C.未反应二氧化硫直接排放,会污染气体,二氧化硫能与氢氧化钠溶液反应,可选用NaOH溶液吸收多余的SO2
,故C不选;
D.应将试管中的溶液倒入水中,防止硫酸溅出伤人,故选D选,
故选:D;
(3)①反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应,故有一定量的硫酸剩余,
故答案为:反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应;
②氯化钡、硝酸钡均与硫酸、硫酸铜反应反应得到硫酸钡沉淀,不能用检验硫酸是否有剩余,剩余的硫酸能与Fe、碳酸钠反应生成气体,据此可以检验硫酸是否有剩余,
故选ad.
点评 本题考查浓硫酸性质探究实验,是对学生综合能力的考查,有利于培养学生的化学实验能力、分析解决问题的能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
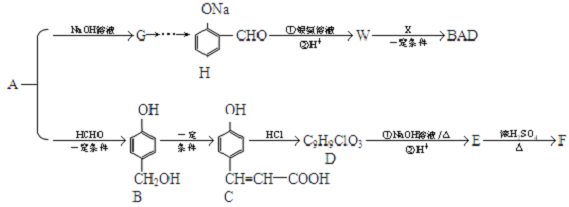
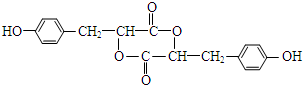
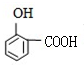 .
.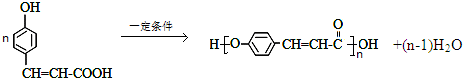 .
.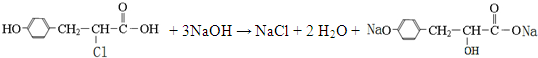 .
.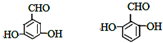 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
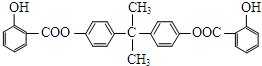
科目:高中化学 来源: 题型:解答题
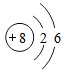 .
.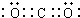 ,Y的结构式为
,Y的结构式为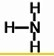 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | NaOH与HCl反应 | Mg(OH)2与HNO3反应 |
| B | 向BaCl2溶液中滴加稀H2SO4 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| C | Cl2通入NaOH溶液中 | Cl2通入澄清石灰水中 |
| D | Fe与HCl反应 | Fe与CH3COOH反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
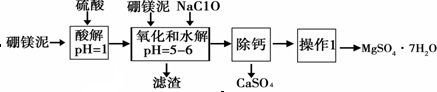
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com